بهکارگیری CRISPR/Cas9 در کنترل وراثت ژنتیکی در موشها
چکیده:
بیولوژیستها با استفاده از تکنولوژی ژنتیک فعال “active genetics”، اولین سازوکار جهان که مبتنی بر CRISPR/Cas9 است را برای کنترل وراثت ژنتیکی در یک پستاندار ایجاد کردند. این دستاورد در موش زمینه های لازم برای پیشرفت های بیشتر بر اساس این تکنولوژی، از جمله تحقیقات بیومدیکال ( زیست پزشکی) در بیماری های انسانی را فراهم میآورد. ممکن است مدل های حیوانی آینده برای بیماری های پیچیده ژنتیکی انسان، مانند آرترید و سرطان، که در حال حاضر امکان پذیر نمی باشد ساخته شوند.
ژنتیک فعال | active genetics
زیست شناسان دانشگاه کالیفرنیا سن دیگو برای اولین بار در جهان سازوکاری که مبتنی بر CRISPR/Cas9 است را برای کنترل وراثت ژنتیکی در یک پستاندار ایجاد کردند. دانشمندان سراسر جهان از CRISPR / Cas9 به منظور ویرایش اطلاعات ژنتیکی در انواع گونههای گیاهی و جانوری بهره میگیرند. سازوکار ویرایش ژنوم می تواند تعیین کند که از دو نسخه یک ژن کدامیک به نسل بعدی منتقل شود. در حالی که سازکار «ژنتیک فعال » در سال های اخیر در حشرات توسعه یافته است، ایجاد چنین ابزارهایی در پستانداران چالش برانگیزتر است چرا که آزمودن آن ، نیازمند زمان طولانی تری است .
یک تیم مشترک از محققان دانشگاه کالیفرنیا سن دیگو یک تکنولوژی جدید ژنتیک فعال را در موش توسعه دادند و در ۲۳ ژانویه در مجله Nature منتشر ساختند. فارغالتحصیل دانشگاه کالیفرنیا سن دیگو دانشجوی کارشناسی ارشد هانا گرونوالد، محقق والنتینو گانتز و همکاران با استادیاری کیمبرلی کوپر زمینه های لازم برای پیشرفت های بیشتر بر اساس این تکنولوژی، از جمله تحقیقات بیومدیکال ( زیست پزشکی ) در بیماری های انسانی را فراهم آورند.
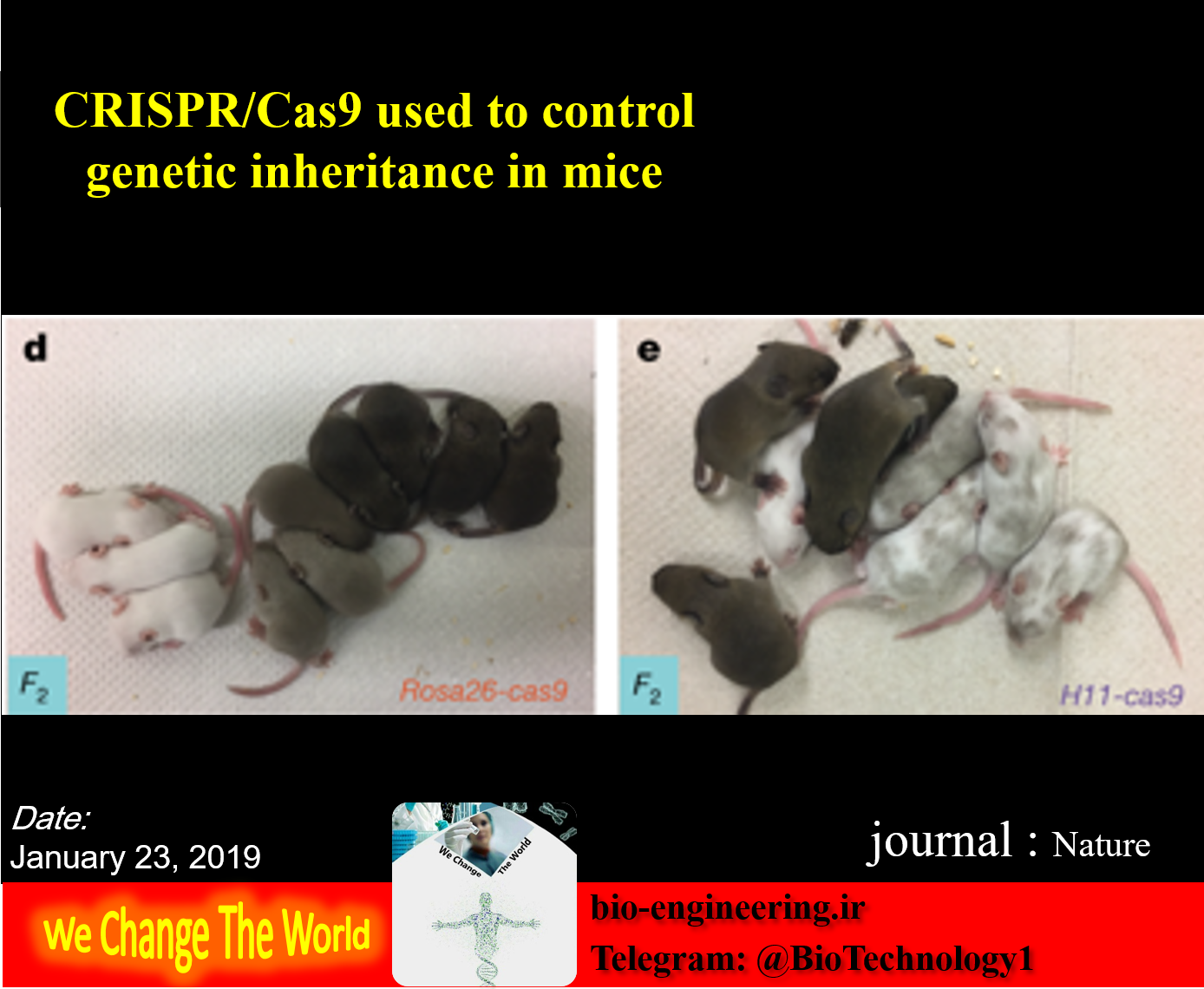
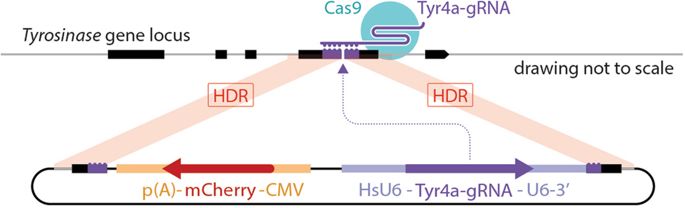
کوپرمی گوید: انگیزه ما این بود که ابزاری برای محققان آزمایشگاهی به منظور کنترل توارث چند ژن در موش ها به وجود آوریم ما تصور میکنیم با توسعه بیشتر این فناوری ایجاد مدل های حیوانی بیماری های پیچیده ژنتیکی انسان ، مانند آرترید و سرطان، که در حال حاضر امکان پذیر نمی باشد، مهیا خواهد شد. برای بررسی امکان انجام این پروسه در موش، محققان یک عنصر «CopyCat» DNA فعال ژنتیکی را به ژن تیروزیناز که کنترل رنگ مو را برعهده دارد وارد نمودند. هنگامی که عنصر (CopyCat) هر دو نسخه از ژن در یک موش را مختل نمود، مویی که میبایست سیاه میبود سفید شده و موفقیت در بازخوانی سازوکار آنها را نشان داد.
عنصر Copy cat نیز به گونه ای طراحی شده است که نتواند آن ویژگی را در میان جمعیت مشابه خود پخش کند یعنی برعکس سیستمهای ژن درایو CRISPR / Cas9 حشرات که بر روی یک مکانیزم مولکولی مشابه ساخته شده اند.در طول دوره دو ساله پروژه، محققان راهکارهای مختلفی را به کار گرفتند تا نحوه کپی کردن عنصر (CopyCat) از یک کروموزوم به دیگری را تعیین نمایند تا بدین وسیله شکست DNA هدف قرار گرفته را با کریسپر/ Cas9 را بازسازی کنند. در نتیجه، عنصری که در ابتدا تنها در یکی از دو کروموزوم موجود بود اکنون در کروموزوم دیگر کپی شده است. در یکی از خانواده ها، به جای 50 درصد معمول، بیش از 86 درصد از فرزندان، عنصر Copy Cat از والد ماده را به ارث بردند.
سازوکار جدید در موش های ماده در طول تخمک گذاری عمل میکند ولی در طی فرایند تولید اسپرم در موشهای مذکر عمل نمی کند. این احتمالا می تواند به دلیل تفاوت در زمان میوز مونث و مذکر که فرایندیست که به طور معمول کروموزمها را برای شافل shuffle کردن ژنوم با هم جفت میکند باشد و شاید این رویداد به کپی برداری مهندسی شده کمک کند.
با توجه به گفته استاد دانشگاه کالیفرنیا سن دیگو اتان بیر، که در نگارش این مقاله همکاری داشته است: نتایج این پژوهش راه را برای کاربردهای مختلف در زیست شناسی مصنوعی شامل مجموعه های مدولار سیستم های ژنتیکی پیچیده برای مطالعه فرآیندهای زیستی متنوع فراهم میکند.
کوپر و اعضای آزمایشگاه او در حال حاضر مشغول تجزیه و تحلیل و تثبیت کردن این اولین موفقیت ژنتیک فعال در پستانداران هستند — بر اساس یک ژن منفرد — و برای گسترش این ابزار به چند ژن و صفات مختلف تلاش میکنند.
کوپر میگوید: ما نشان داده ایم که می توانیم یک ژنوتیپ هتروزیگوت را به هموزیگوت تبدیل کنیم. حالا ما می خواهیم ببینیم که آیا میشود به شکل موثر توارث سه ژن در یک حیوان را کنترل کرد. اگر بتوان این کار را به یکباره برای چند ژن اجرا کرد، می تواند انقلابی در ژنتیک موش ایجاد کند.
در حالی که فن آوری جدید برای تحقیقات آزمایشگاهی ایجاد شده است، برخی براین باورند که درایوهای ژن آینده که براساس این سازوکار ساخته میشود میتواند تعادل تنوع زیستی طبیعی در اکوسیستمهایی که تحت حمله توسط گونه های مهاجم، از جمله جوندگان هستند را برقرار نماید.
بیر میگوید: با برخی اصلاحات، شاید ممکن باشد که فن آوری ژن درایوی را ایجاد کنیم که پستاندارانی که عامل برخی بیماریها هستند یا باعث آسیب به گونه های بومی میشوند تغییر دهیم و یا احتمالا جمعیتشان را کم کنیم.
با این حال، این داده ها نشان می دهند که پیشرفت های فنی مورد نیاز برای استفاده عملی در طبیعت به جهت در نظر گرفتن دقیق چگونگی به کارگرفتن این تکنولوژی جدید نیازمند زمان است. محققان متذکر میشوند، که نتایج حاصله نشان از یک پیشرفت قابل توجه دارد که میتواند به کاهش زمان، هزینه و تعداد حیوانات مورد نیاز برای پیشبرد تحقیقات زیست پزشکی ( بیومدیکال) در بیماری های انسانی و به درک انواع دیگر صفات ژنتیکی پیچیده کمک کند .
کوپر میگوید: ما همچنین به درک مکانیسم تکامل نیز علاقمند هستیم. برای صفات خاصی که بیش از ده ها میلیون ها سال تکامل یافته، تعداد بیشتری از تغییرات ژنتیکی فعلی نیاز است تا دریابیم به طور مثال چه باعث شد تا انگشتان خفاش به شکل بال درآیند. بنابراین ما می خواهیم شمار زیادی از این ابزار ژنتیکی فعال را بسازیم تا ریشه های تنوع پستانداران را کشف کنیم.
گونار پابلوفسکی عضو فوق دکترای پیشین دانشگاه کالیفرنیا سندیگو (مولف ارشد و همکار فعلی در دانشگاه ملی سنگاپور) و دانشیار پژوهشی ژیانگ رو ژو نیز در این پژوهش همکاری داشتند.
Story Source:
Materials provided by University of California – San Diego. Original written by Mario Aguilera. Note: Content may be edited for style and length.
Journal Reference:
Hannah A. Grunwald, Valentino M. Gantz, Gunnar Poplawski, Xiang-Ru S. Xu, Ethan Bier & Kimberly L. Cooper. Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline. Nature, 2019 DOI: 10.1038/s41586-019-0875-2





