
در کمال شگفتی، دانشمندان به فرایندی پی بردند که سرطان را قبل از آغاز آن متوقف میکند
پروسه بازیابی سلولی که گمان برده می شود که عامل رشد سرطان است در واقع میتواند از آن پیشگیری نماید.
خلاصه
اتوفاژی autophgy
دانشمندان طی مطالعه در مورد رابطه تلومرها با سرطان یک کشف شگفت آوری داشتند: یک فرایند بازیابی سلولی به نام autophgy (اتوفاژی)- که عموما به عنوان یک مکانیسم بقا شناخته میشود – در واقع مرگ سلولها را افزایش و در نتیجه جلوگیری از شروع سرطان را موجب میشود.
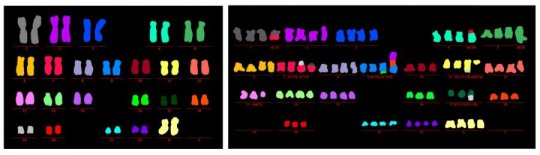
شکل سمت چپ:
23 جفت کروموزوم سلولی که در آن autophagy عمل می کند، طبیعی و سالم هستند و بدون هیچ انحراف ساختاری یا عددی (هر رنگ بیانگر یک جفت کروموزوم منحصر به فرد) است.
شکل سمت راست:
کروموزوم های سلول هایی که در آن autophagy کار بحرانی را انجام نمی دهد، نشان می دهد که هر دو انحراف ساختاری و عددی، با بخش های اضافه شده، حذف شده و / یا مبادله بین کروموزوم ها – نشانه سرطان است.
درست مانند نوک های پلاستیکی که در انتهای بند کفش وجود دارد و مانع از ریش ریش شدن آن به هنگام گره زدن آن میشود قطعهای مولکولی به نام تلومر از انتهای کروموزوم ها محافظت کرده و آنها را از آمیخته شدن در زمانی که سلول مرتبا تقسیم و تکثیر DNA می شود ،مصون میدارد. اما در حالی که از دست دادن قطعه پلاستیکی بند کفش ممکن است به یک بند کفش بهم ریخته ختم شود، از دست دادن تلومر ممکن است به سرطان منجر گردد.
دانشمندان موسسه سالک در بررسی رابطه تلومرها و سرطان به یک کشف شگفت آور رسیدند: یک فرایند بازیابی سلولی به نام اتوفاژی– که عموما به عنوان یک مکانیسم بقا شناخته میشود – در واقع مرگ سلولها و در نتیجه جلوگیری از شروع سرطان را موجب میشود.
این پژوهش، که در مجله Nature در تاریخ 23 ژانویه 2019 منتشر شد، نشان می دهد اتوفاژی یک مسیر کاملا جدید برای سرکوب تومورها است و نشان می دهد که درمان هایی که موجب بلوکه کردن پروسه برای جلوگیری از پیشرفت سرطان به کار برده می شود ، ممکن است ناآگاهانه تحریک زودهنگام آن را در پی داشته باشد.
جان کراسلر، استاد نویسنده ارشد مقاله و استاد در موسسه سالک در آزمایشگاه مولکولی و زیست شناسی سلولی و نویسنده ارشد میگوید: این نتایج شگقت آوربود. نقاط کنترل بسیاری برای جلوگیری سلول از تقسیم خارج از کنترل و تبدیل شدن به سلول های سرطانی وجود دارد اما ما انتظار نداشتیم اتوفاژی یکی از آنها باشد.
هربار که سلول ها DNA خود را به منظور رشد تقسیم می کنند، تلومرهایشان کمی کوتاه تر میشوند و در نتیجه زمانی که تلومرها بسیار کوتاه می شوند ، آنها دیگر نمی توانند از کررومزمها به شکل موثر محافظت کرده سلول سیگنالی مبتنی بر توقفدائمی تقسیم دریافت میکند. اما گاهی به علت ویروس سرطان زا یا عوامل دیگر، سلول ها این پیام را دریافت نمی کنند و به تقسیم شدن ادامه می دهند. با دارا بودن تلومرهایی به شدت کوتاه یا عدم حضورآنها، سلول وارد حالتی به نام بحران میشود، که در آن کروموزوم محافظت نشده می تواند بهم ریخته و ناکارآمد شود – که مشخصه برخی از سرطان هاست.
تیم کارسلر میخواستند درک بهتری از حالت بحران پیدا کنند — هم به دلیل اینکه بحران اغلب منجر به مرگ گسترده سلولی میشود و درنتیجه مانع از این میشود که سلول های پیش سرطانی در ادامه به سرطان مرگبار بدل شوند و هم به این علت که مکانیزم موجود در پس اینگونه مرگ های مفید سلول به خوبی شناخته شده نیست.
جو ناسور، فوق دکترا در آزمایشگاه کراسلر و و نویسنده ارشد مقاله میگوید: بسیاری از محققان مرگ سلولی در حالت بحران از طریق آپوپتوز، که همراه با اتوفاژی است را یکی از دو نوع مرگ سلولی برنامه ریزی شده است، میدانند. اما تا کنون هیچ کس آزمایشی برای تشخیص صحت این مدعا انجام نداده بود.
برای بررسی بحران و مرگ سلولی که به طور معمول رخ میدهد ، کارسلر و ناسور از سلول های سالم انسان استفاده کردند تا یک سری آزمایش ها را به منظور مقایسه حالت رشد معمول سلول ها با سلول های حالت بحران انجام دهند. با غیر فعال کردن ژن های مختلف محدود کننده رشد (همچنین به عنوان ژن سرکوب کننده تومور شناخته می شود)، گروه آنها توانست سلولها را وادار کند که بدون توقف تلومرهای خود را کوتاه تر و کوتاه تر کنند.
برای تشخیص اینکه کدام نوع مرگ سلولی مسئول عمده مرگ در حالت بحران بوده است، آنها نشانگر های مورفولوژیکی و بیوشیمیایی از هر دو آپوپتوز و اتوفاژی را مورد بررسی قرار دادند. اگر چه هر دو مکانیسم مسئول مرگ تعداد کمی از سلولها در حالت رشد معمول بودند ولی اتوفاژی مکانیسم به مراتب غالبتری در مرگ سلولی گروهی بود که در آن سلول های بسیار بیشتری از بین رفتند.
سپس محققان به بررسی این موضوع پرداختند که در هنگام جلوگیری از اتوفاژی در سلول های بحرانی چه رخ میدهد. نتیجه بسیار جالب بود: بدون مرگ سلولی از طریق اتوفاژی، سلول مکررا به همانند سازی خود میپرداخت. علاوه بر این، زمانی که تیم به کروموزوم های این سلول ها نگاه کرد ، آنها به هم ریخته و از شکل افتاده بودند که نشان می داد در DNA سلول های سرطانی آسیب جدی در حال وقوع بوده و مشخص گردید اتوفاژی به عنوان یک مکانیسم مهم سرکوب در مراحل اولیه سرطان محسوب میگردد.
در نهایت، گروه به بررسی این موضوع پرداخت که در هنگام وارد ساختن انواع خاصی از آسیب DNA در سلول های طبیعی، چه به انتهای کروموزوم (از طریق از دست دادن تلومر) و یا در مناطق وسط چه روی می دهد. سلول هایی که تلومر از دست داده بودند اتوفاژی را فعال کردند، در حالی که در سلول هایی که دارای آسیب DNA به سایر مناطق کروموزومی بودند آپوپتوز فعال می شود. این نشان می دهد که آپوپتوز تنها سازوکار برای از بین بردن سلول های پیش سرطانی نیست که ممکن است به علت آسیب به DNA رخ دهد و رابطهای مستقیم بین تلومرها و اتوفاژی وجود دارد.
این کار نشان می دهد که، اتوفاژی به جای اینکه یک مکانیسمی باشد که باعث سرعت بخشیدن به رشد غیرمجاز سلول های سرطانی (توسط، همنوع خواری سلول های دیگر به منظور بازیابی مواد خام) باشد، در واقع سپردفاعی در دربرابر چنین رشدی است.بدون اتوفاژی، سلول هایی که سایر عوامل ایمنی مانند ژن سرکوب کننده توموری را از دست دادهاند، به سوی یک وضعیت بحران رشد بدون نقاط کنترل یا همان آسیب DNA بی حد و حصر و اغلب سرطان پیش میروند. (براساس یک مطالعه در سال 2015 توسط روبن شاو استاد سالک که یکی از مولفان همکاری کننده در این مقاله است هنگامی که سرطان آغاز شد، مسدود کردن اتوفاژی ممکن است هنوز هم یک استراتژی درست برای گرسنگی دادن به یک تومور محسوب شود.)
کارسلر، که دارای منصب دونالد و دارلین شیلی است، اضافه می کند: این کار هیجان انگیز است زیرا اکتشافات کاملا جدیدی در آن وجود دارد. ما نمیدانستیم برای سلول ها، زنده ماندن در حالت بحران امکان پذیر است؛ ما نمیدانستیم اتوفاژی با مرگ سلول در بحران ارتباط دارد؛ ما قطعا نمی دانستیم که چگونه اتوفاژی مانع از تجمع آسیب های ژنتیکی میشود. این دستاوردها حوزه کاملا جدیدی از پژوهش را به سوی ما میگشایند.
در آینده محققان در نظر دارند با دقت بیشتری به بررسی شکاف در مسیر مرگ سلول به دلیل آسیب به انتهای کروموزوم (تلومرها) که منجر به اتوفاژی میشود بپردازند در حالی که آسیب به سایر نقاط از کروموزوم منجر به آپوپتوزمیگردد.
Date:
January 23, 2019
Source:
Salk Institute
Story Source:
Materials provided by Salk Institute. Note: Content may be edited for style and length.
Journal Reference:
Joe Nassour, Robert Radford, Adriana Correia, Javier Miralles Fusté, Brigitte Schoell, Anna Jauch, Reuben J. Shaw & Jan Karlseder. Autophagic cell death restricts chromosomal instability during replicative crisis. Nature, 2019 DOI: 10.1038/s41586-019-0885-0



7 دیدگاه ها
مثل همیشه عااااالی
مطلب عالی بود
ممنون از مطالب خوبتون
مطلب بسیار عالی بود
با تشکر از سایت خوبتون
مطلب عالی بود
جالب مثل همیشه
ممنون از سایت خوبتون آقای کارگر