
اصول کلی روش الکتروفورز (Electrophoresis)
(Electrophoresis) الکتروفورز :
الکتروفورز یکی از تکنیکهای آنالیتیکی قدرتمند در جداسازی و آنالیز دامنه وسیعی از آنالیتهای یونیزه محسوب میگردد. آنالیتهایی که بطور ویژه مورد توجه قرار میگیرند عبارتند از: پروتئینها , پپتیدها , آمینواسیدها , اسیدهای نوکلئیک و اولیگونوکلئوتیدها , نوکلئوزیها , اسیدهای آلی و آنیونها و کاتیونهای کوچک موجود در مایعات و بافتهای بدن. اصطلاح الکتروفورز اشاره به حرکت همه ترکیبات یا ذرات باردار در یک محلول (محیط مایع) تحت تاثیر جریان الکتریکی دارد.
ترکیبات شیمیایی دارای بار الکتریکی به سمت قطب آند و یا کاتد (با توجه به نوع بار الکتریکی) حرکت ترکیباتی هستند که وابسته به نوع محیط (قلیایی بودن یا اسیدی بودن) (Ampholytes) مینمایند. آمفولیتها میباشند و نیز –NH2 , -COOH دارای بار منفی یا بار مثبت میباشند. از آنجایی که پروتئینها حاوی گروههای بارهای موجود در اسیدهای نوکلئیک میتوانند به صورت مثبت و یا منفی باشند , در محلولها دارای رفتاری مشابه رفتار آمفولیتها میباشند.
سرعت حرکت ترکیبات موجود در یک نمونه در الکتروفورز به عوامل زیر وابسته است:
1. بار الکتریکی خالص یون .
2. اندازه و شکل یون .
3. شدت میدان الکتریکی.
4. خواص محیط پایه (Support medium)
5. دمای محیط الکتروفورزی.
حرکت الکتروفورزی (μ) :
برحسب تعریف عبارت است از میزان حرکت ذرات برحسب cm/s در واحد میدان الکتریکی برحسب Volt/cm که با μ نشان داده میشود و برحسب cm2/V.s بیان میگردد:
حرکت الکتروفورزی : μ
بار الکتریکی خالص یون : Q
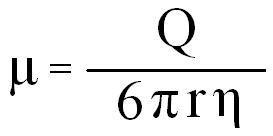
شعاع یون : r
ویسکوزیته محیط(بافر) : η
بطورکلی نیروهای تاثیر گذارنده بر حرکت الکتروفورزی را میتوان به دو گروه تقسیم نمود:
نیروی رانشی یا جلوبرنده (Driving force) : که مرتبط با میدان الکتریکی یون مربوطه میباشد.
نیروی بازدارنده (Retarding force) : که مربوط به مقاومت محیط نگهدارنده میباشد.
با توجه به معادله بالا مشخص میگردد که حرکت الکتروفورزی ارتباط مستقیم با بار خالص یون(Q) و ارتباط معکوس با اندازه ملکول (r) و ویسکوزیته محیط الکتروفورزی (η) دارد. هنگامی که الکتروفورز در حال انجام میباشد به مرور دمای محیط پایه و بافرها افزایش مییابد که منتج به تبخیر حلال میگردد, این اثر (خشک کنندگی) سبب صعود بافر از هردو بخش بافری(درون دو تانک بافری) به درون محیط پایه میگردد, این جریان دوطرفه بر حرکت یونها تاثیر میگذارد (Wick flow).
مقاله مرتبط :
جزوه ژل الکتروفورز ژل آگارز همراه با فیلم آموزشی (فارسی)
کلیپ آموزشی ژل الکتروفورز
کلیپ قالب گیری ژل الکتروفورز
وسایل و مواد مورد نیاز الکتروفورز :
یک دستگاه (سیستم) الکتروفورز شامل بخشهای زیر میباشد:
دو تانک بافر (Buffer boxes) که بافرهای الکتروفورزی در آن ریخته میشود
الکترودها
محیط پایه الکتروفورزی (Support media)
صفحه پوشاننده (Cover) جهت جلوگیری از تبخیر
سیستم تامین کننده جریان الکتریکی (Power supply)
بافر(تامپون)
محیط پایه الکتروفورزی (Support media)

محیط پایه الکتروفورزی (Support media) :
ژل نشاسته نخستین ژلی بود که برای جداسازی الکتروفورزی استفاده گردید. در حال حاضر از آگارز , استات سلولز و پلیآکریلامید استفاده میگردد.
ژل آگارز (Agarose) :
آگار پلی ساکارید اسیدی کمپلکسی میباشد که محتوی منومرهایی از گالاکتوز سولفاته میباشد. آگارز در واقع همان آگاری میباشد. آگارز در واقع همان آگاری میباشد که فاقد گروه سولفات میباشد. ناخالصی در آگارز و وجود آگار و آگاروپکتین(که دارای گروههای سولفات و کربوکسیلیک اسید میباشند) موجب اختلال در حرکت ملکولها و نیز در رنگآمیزی میگردد ولی در آگارز خالص به دلیل اینکه گروههای قابل یونیزه مذکور وجود ندارد , کارایی بهتری در جداسازی ترکیبات به روش الکتروفورز (نسبت به ترکیبات مذکور) دارد. از لحاظ عملی محلولهای بافر حاوی 0.5 تا 1 gr/dL آگارز، ایجاد کننده ژلی با قدرت یونی مناسب برای جداسازی پروتئینها و قطعات DNA با طول 0.5 تا 20 هزار جفت باز می باشد.
اندازه حفره موجود در ژل , بستگی به غلظت آگارز در بافر دارد. هر باند تفکیک شده حاوی چندین پروتئین با حرکت الکتروفورزی یکسان میباشد. در این نوع از محیطهای الکتروفورزی , باندها بیشتر به صورت پهن دیده می شوند زیرا ژل آگارز نسبت به محیطهای دیگر مانند استات سلولز نسبت پروتئینها از نفوذپذیری بالایی برخوردار میباشد.
استات سلولز :
کاغذها بیشتر از جنبه جداسازی ترکیبات با وزن ملکولی پایین حائز اهمیت میباشند. مزیت اصلی این محیطها نازک بودن و قدرت مکانیکی آنهاست. این محیطها دارای حساسیت بیشتری میباشند زیرا به نمونه کمتری برای ایجاد لکه ها یا باندهای قابل تشخیص دارند. کاغذ استات سلولز از جمله این محیطهاست. استات سلولز بوسیله قرار دادن کاغذ سلولز در مجاورت انیدرید استیک ایجاد میگردد. گروه استیل بر روی گروههای هیدروکسیل قند قرار میگیرد.
ژل پلی آکریلامید :
از پلیمریزاسیون آکریلامید در حضور حرارت ایجاد میگردد که ممکن است دارای پیوندهای متقاطع یا فاقد باشد. ژل پلیآکریلامید پایدار در برابر حرارت بوده و شفاف میباشد و همچنین (Cross link) پیوندهای متقاطع فاقد بار الکتریکی میباشد به همین دلیل تداخلی که در ژل آگارز وجود داشت در اینجا وجود ندارد. به علت خاصیت کارسینوژنیک (سرطانزایی) آکریلامید , باید توجه داشت که این ترکیب با سطح پوست برخورد نداشته باشد. ژل پلی متیلن بیس آکریلامید(بیس آکریلامید) شکل میگیرد. – N,N آکریلامید از ترکیب آکریلامید و یک ماده رابط بنام بدین صورت که ملکولهای آکریلامید بصورت طولی به هم متصل میگردند و ماده رابط نیز مسئول تولید پلهای عرضی متعدد بین رشته های آکریلامید است. خصوصیات فیزیکی ژل از قبیل اندازه منافذ , خاصیت الاستیکی , چگالی ژل و قوام مکانیکی متاثر از غلظت دو جزء تشکیل دهنده آن است. پلیمریزاسیون آکریلامید یک واکنش
رادیکالی است که توسط پراکسیداز یا انرژی فتوشیمیایی شروع میشود.
بافرها:
اعمال بافرها در فرایند الکتروفورز عبارت است از:
1. عبور دادن جریان الکتریکی
2. ثابت نگه داشتن pH محیط
3. تعیین بار الکتریکی سطح ترکیب موجود در نمونه
از عوامل بسیار اساسی در الکتروفورز pH نوع بافر و خصوصیات آن از قبیل قدرت یونی , ظرفیت بافری و معین و قدرت یونی خاص صورت میگیرد.جداسازی ملکولها در الکتروفورز در یک pH محسوب میگردد.
رنگ آمیزی ژلهای الکتروفورزی (Staining) :
رنگ آمیزی ژلها (محیطهای پایه)ی الکتروفورزی جهت آشکار شدن جایگاه باندهای پروتئین و … صورت میگیرد. انتخاب رنگها با توجه به نوع ژل و نوع ترکیب مورد جداسازی صورت میگیرد. میزان رنگ هر باند با میزان پروتئین موجود در آن باند ارتباط دارد ولی این میزان تحت تاثیر عوامل دیگری نظیر نوع پروتئین و میزان دناتوراسیون آن قرار میگیرد. وقتی از رنگ آمیزی پروتئینها استفاده میشود بخش لیپیدی لیپوپروتئین ها یا کربوهیدراتی گلیکوپروتئین ها رنگ نمیشود. لذا مقادیر آنها کمتر از میزان واقعی برآورد خواهد شد.
رنگ آمیزی پروتئین ها :
از رنگهای آمیدوبلاک (Amido black)، کوماسی بریلیانت بلو (CBB)، پانسو S (Panseau S) و نیترات نقره استفاده می شود.
رنگ آمیزی لیپوپروتئین ها :
از رنگهای سودان بلاک، کوماسی بریلیانت بلو (CBB) و Oil Red 0 استفاده می شود.
رنگ آمیزی گلیکوپروتئین ها :
از رنگ Periodic Acid Schiff یا (PAS) استفاده می شود.
رنگ آمیزی اسیدهای نوکلئیک :
استفاده از اتیدیوم بروماید (Ethidium bromide) و نیترات نقره
رنگ آمیزی دهیدروژنازها :
استفاده از NADH (دارای خاصیت فلوئورسان) و نمک تترازولیوم (نیتروبلوتترازولیوم)

تشخیص و تعیین کمی اجزای باندهای تشکیل شده :
معمولترین روش تعیین مقدار اجزای باندهای الکتروفورزی, چگالی سنجی یا دانسیتومتری است (به دستگاه مزبور نیز دانسیتومتر (Densitometry) گفته میشود که به عنوان یک فتومتر فیلتردار و وسیله رسم منحنی محسوب میگردد) که در آن از باندهای مختلف یک محیط الکتروفورتیک شفاف (فاقد رنگ زمینه ای) و ثابت شده, اسکن تهیه و این اسکن به صورت توالی از قله های مجزا , به نام الکتروفورتوگرام نمایش داده میشود.
سطح منحنی زیر این قلهها متناسب با غلظت پروتئینهای موجود در هر باند میباشد. برای مثال, به این طریق میتوان درصد پروتئینهای موجود در هر کدام از باندهای الکتروفورتیک پروتئینهای سرم را بدست آورد. با ضرب کردن این درصدها در میزان تام پروتئینهای سرم, غلظت هر باند محاسبه میگردد (شکل زیر).

انواع روشهای الکتروفورزی
بسته به اینکه الکتروفورز در یک سطح افقی انجام گیرد یا در یک سطح عمودی به ترتیب به نوع روشهای مذکور
الکتروفورز افقی و الکتروفورز عمودی گفته میشود. از سوی دیگر براساس نوع محیط پایه و مواد شیمیایی مورد
استفاده و همچنین نوع مکانیسم جداسازی, روشهای الکتروفورزی تنوع زیادی پیدا کردهاند. ازجمله میتوان انواع زیر
را نام برد:
الکتروفورز بر روی ژل آگارز (Agarose Gel Electrophoresis or AGE)
الکتروفورز بر روی استات سلولز (Cellulose Acetate Electrophoresis or CAE)
الکتروفورز بر روی ژل پلی آکریلامید (Polyacrylamide Gel Electrophoresis or PAGE)
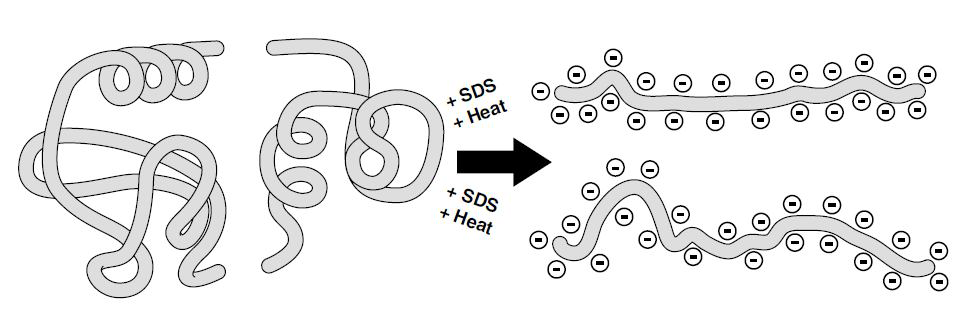
روش SDS-PAGE
که همان روش PAGE می باشد بعلاوه اینکه در اینجا از یک دترژانت به نام سدیم دو دسیل سولفات یا SDS استفاده میگردد که باعث اتصال به سطح ترکیباتی مانند پروتئین ها گردیده و باعث ایجاد بار منفی بر سطح همه آنها میگردد (شکل پایین). میزان بار منفی تشکیل شده بر سطح پروتئینها به اندازه و وزن ملکولی آنها بستگی دارد, بنابراین جداسازی در این روش بر اساس وزن ملکولی ترکیبات صورت خواهد گرفت).
ایزوالکتریک فوکوسینگ (Isoelectric focusing or IEF) – که در این روش از محیط الکتروفورزی با گرادیانی(شیبی) از pH استفاده میگردد که پروتئین ها براساس pH ایزوالکتریکشان جداسازی میگردند.




1 نظر
[…] روش الکتروفورز […]