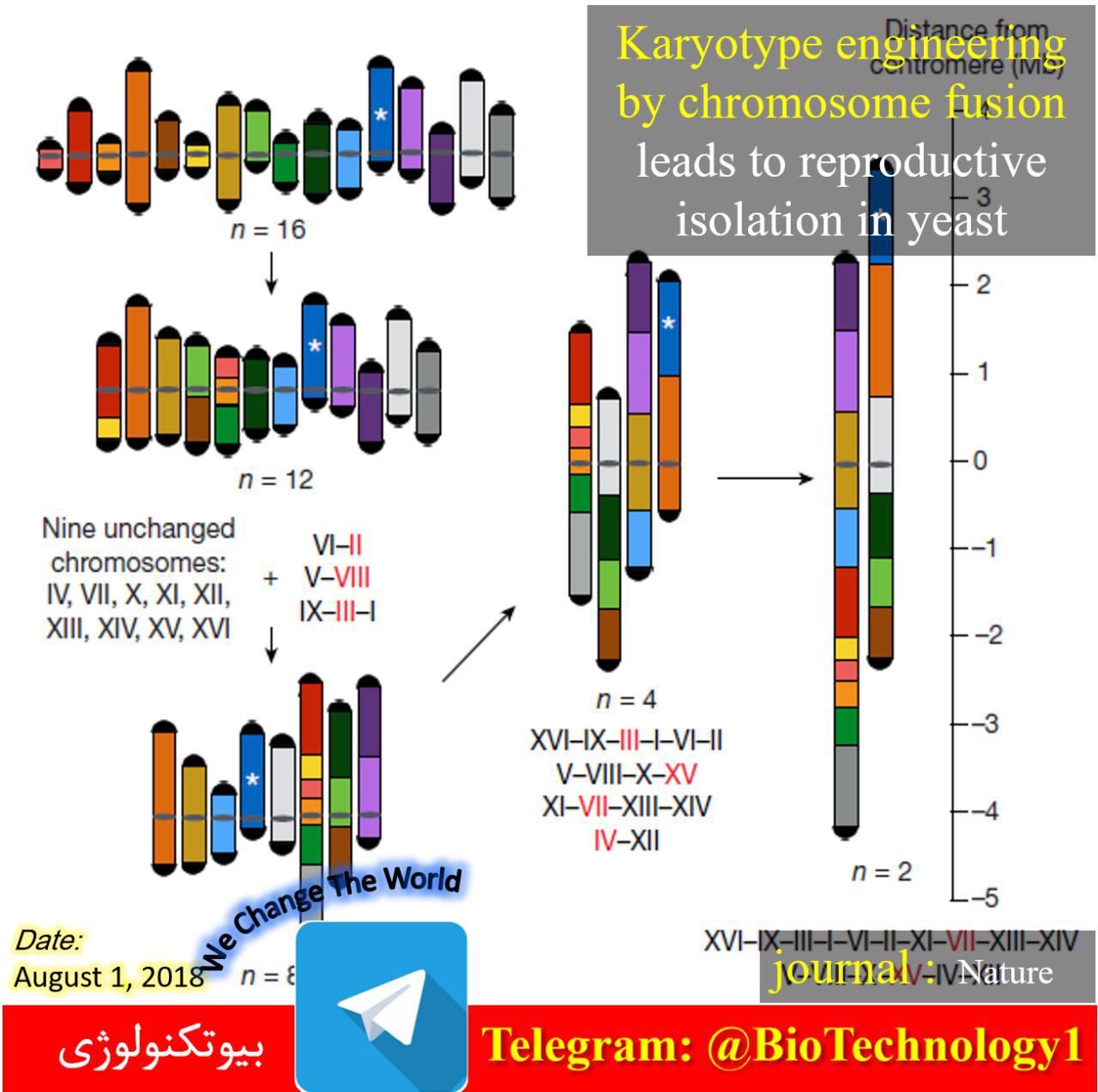
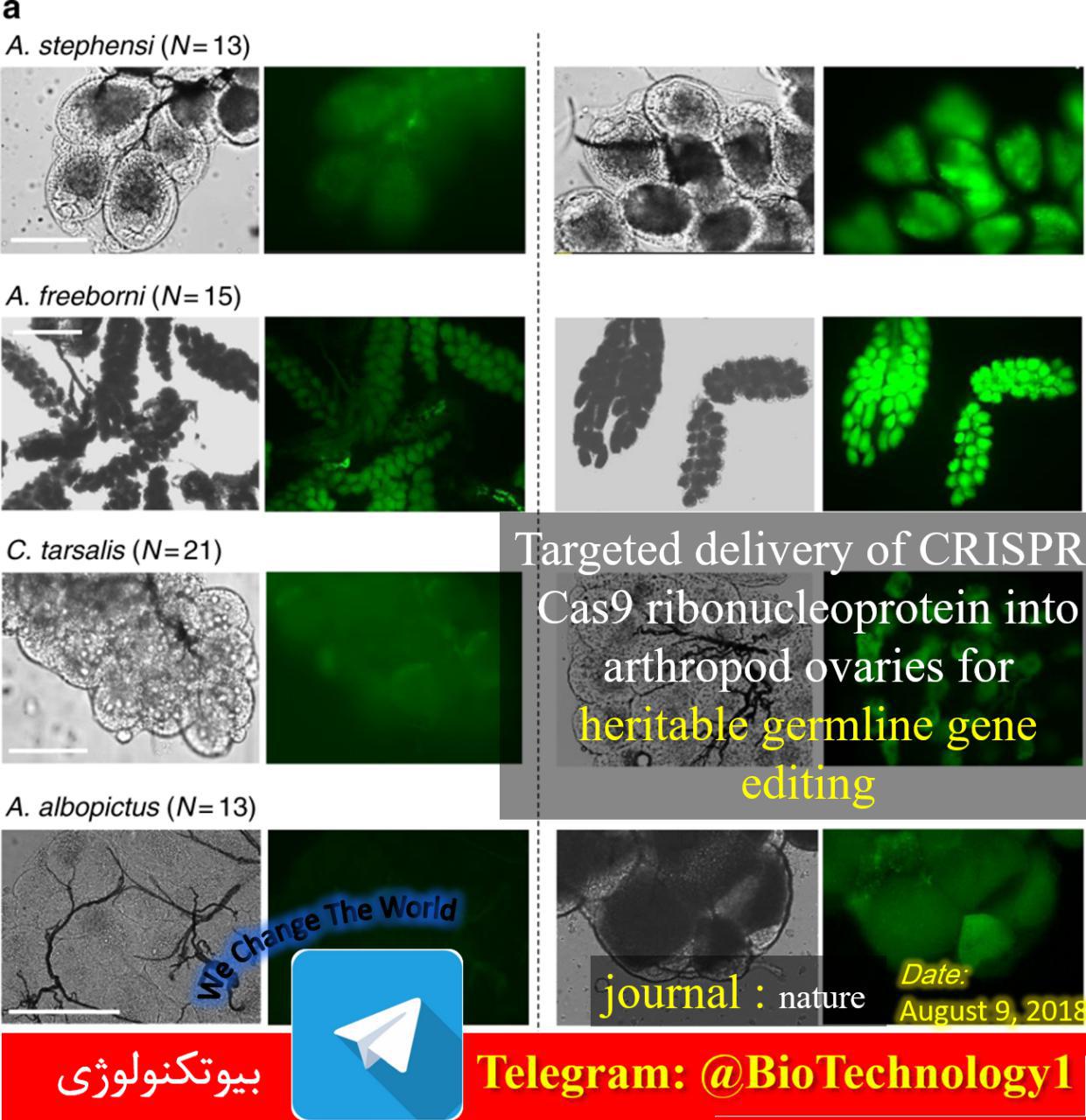
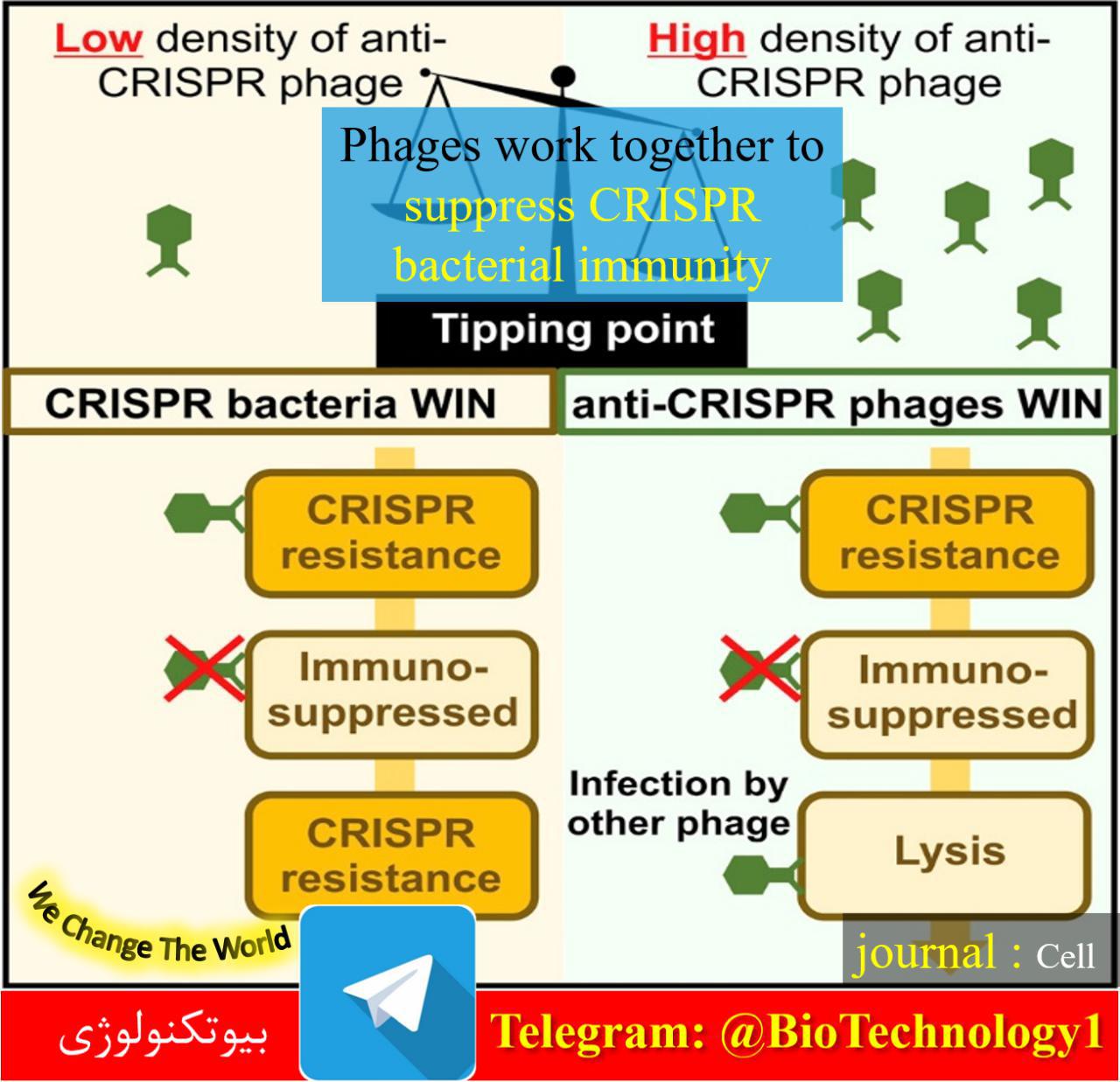
ویرایش ژنوم چیست؟ عبارت «ژنوم» به مواد ژنتیکی موجود زنده اشاره دارد. ژنوم یک ارگانیسم شامل کل DNA هستهای، از جمله نواحی کدکننده و غیر کدکننده، و همچنین DNA میتوکندری و کلروپلاست موجود در سلول است. مطالعه مواد ژنتیکی برای…
ویرایش محتوا
درباره ما
بیوتکر سفیر ترویج زیست فناوری و مرجع دانستی های بیوتکنولوژی. اینجا با هم کلی کتاب و مقاله علمی با موضوعات جذاب می خونیم
با ما تماس بگیرید
- تهران، میدان انقلاب، خیابان کارگر شمالی
- 09367305950
- saeedkargar@gmail.com
- ساعات کاری : شنبه تا جمعه (8 صبح تا 10 شب)