چکیده تکنیک PCR
اختراع واکنش زنجیره ای پلیمراز نقطه عطفی در تاریخ علوم زیستی و پزشکی است. کاربرد PCR نه تنها به طور کامل در زمینه تحقیقات ژنتیک مولکولی به خصوص در بیوتکنولوژی جانوری و گیاهی انقلابی ایجاد کرده است بلکه این تکنیک، ارتباط و کارایی مبتکرانه خود را در زمینه های
دیگر علم پزشکی قانونی، سیستماتیک مولکولی، اپیدمیولوژی مولکولی، باستان شناسی، مردم شناسی، ژنتیک تکاملی و غیره نیز ثابت کرده است. PCR سنتی منجر به ظهور RT-PCR، qPCR و ترکیب RT-PCR/qPCR شده است.
همچنین PCR قادر است با موفقیت “پروژه ژنوم انسان” را از طریق توانایی تکثیر و توالی یابی ژن های انسان، تکمیل کند که بیشتر پایه و اساس مهندسی ژنتیک شده است و حتی در حال حاضر ایجاد تغییرات مفید در ژنوم یک ارگانیسم را امکان پذیر ساخته است. واریانت های PCR در بسیاری از پیشرفت های اخیر که علوم دوره مدرن را ایجاد کرده اند به
طور موفقیت آمیزی مورد استفاده واقع شده است.
مقدمه تکنیک PCR
واکنش زنجیره ای پلیمراز (PCR) سنگ بنا در زمینه ژنتیک مولکولی توسط Francis Crick و James D. Watson در سال 1953 با ارائه مدل ساختار دو رشته های DNA گذاشته شد. در اوایل 1960 ، توسط دکتر Gobind Khorana برنده جایزه نوبل در سال 1968 پیشرفت های قابل توجهی جهت روشن سازی کد ژنتیکی و سنتز اولیگونوکلئوتیدها که به عنوان الگوی پرایمری برای DNA پلیمراز استفاده می شوند، حاصل شد. Kjell Kleppe در سال 1971
پژوهشگر آزمایشگاه Khorana، همانند سازی قطعه ای از DNA را با استفاده از سیستم دو پرایمری توصیف کرد. واکنش زنجیره ای پلیمراز یک تکنیک آزمایشگاهی است که همانند سازی و تکثیر قطعه ای از DNA را به میلیون ها برابر آن امکان پذیر می سازد.
تکنیک واکنش زنجیره ای پلیمراز توسط Kary Banks Mullis، در سال 1983 وقتی که وی به عنوان بیوتکنولوژیست در موسسه Emeryville، Cetus کالیفرنیای آمریکا کار می کرد، ابداع شد. در سال 1985 سرمایه به عنوان بیوتکنولوژیست در موسسه Perkin-Elmer و Cetus دیگر شرکت آمریکایی بیوتکنولوژی جهت طراحی ابزار چرخه حرارتی و معرف ها برای PCR صورت گرفت و در 1987 مطبوعات خبر دسترسی تجاری “PCR-1000 Thermal Cycler” و “DNA پلیمراز AmpliTaq” منتشر کردند، این اختراع، جایزه نوبل افتخارات خود را در شیمی و همچنین جایزه ژاپن را در سال 1993 از آن خود کرد.

کری مولیس
اجزای لازم برای PCR استاندارد
اجزای مخلوط واکنش تکنیک PCR
Taq/دیگر پلیمرازهای مقاوم به حرارت
DNA الگو
پرایمرها
داکسی نوکلئوتید تری فسفات ها (dNTPs)
MgCl2
پیپت خودکار/ظروف پلاستیکی/دستکش
دستگاه چرخه حرارتی (ترمال سایکلر)
Taq و دیگر پلیمرازهای مقاوم به حرارت

اجزای مخلوط واکنش تکنیک PCR
در سال 1969، Thomas D. Brock ترموفیلوس اکواتیکوس، گونه جدیدی از باکتری گرما دوست موجود در بخش زیرین چشمه آب گرم پارک ملی Yellowstone پلیمراز « جداسازی کرد. در سال 1976 آنزیم مقاوم به حرارت Taq از Thermus aquaticus ایزوله شد در سال 1986، HenryErlich استفاده از پلیمراز Taq را در PCR خبر داد، چون این آنزیم می تواند فعالیت خود را در طیف وسیعی از درجه حرارت بالا حفظ کند اضافه کردن آن به مخلوط PCR کل روند PCR را بدون نیاز به اضافه کردن دستی DNA پلیمراز تازه از اشریشیاکلی در هر چرخه واکنش، کوتاه تر می کند زیرا DNA پلیمراز اشریشیاکلی قادر به تحمل گرمایش و سرمایش سریع نیست.
مسیر سنتیکی Taq پلیمراز در سنتز رشته الگو با واردکردن نوکلئوتیدی ها به وسیله Rothwell و Waksman در 2005 توصیف شده است. بسیاری از DNA پلیمرازهای مقاوم به حرارت نیز کشف شده اند که می توان برحسب کاربردشان از آن ها استفاده کرد (جدول 1) معمولا از 1-1.5 DNA پلیمراز Taq در 50μ از مخلوط واکنش مورد نیاز است. با این حال اگر مهارکننده ها (مثل درجه خلوص پایین DNA الگو) در مخلوط واکنش وجود داشته باشد، مقدار بالای DNA پلیمراز Taq (2-3U) جهت حصول بازده بهتر محصولات تکثیرشده، لازم است.
DNA الگو :
معمولا از 0.1 – 1 نانوگرم DNA الگو برای DNA پلاسمید یا فاژ و 0.1 – 1 میکرگرم برای DNA ژنومی در 50μl مخلوط تام واکنش مورد نیاز است. DNA الگوی بیشتر از این مقدار سبب تولید فرآورده های غیر اختصاصی PCR می شود؛ بنابراین باید DNA خالص باشد به طوری که، حتی وجود مقدار خیلی جزئی از فنول،EDTA، پروتئیناز K و غیره مورد استفاده در جداسازی DNA شدیدا فعالیت DNA پلیمراز Taq می کند. با این حال رسوب DNA با اتانول و شستشوی پلیت DNA با اتانول 70 % معمولا در حذف این آلودگی ها از نمونه DNA مؤثر هستند.
پرایمرها :
موضوع بسیار مهم برای تکثیر جایگا ه های هدف در داخل یک ناحیه ای از ژنوم، طراحی پرایمر است. پرایمر موفق عمدتا برای دستیابی به دو هدف یعنی ویژگی و کارایی طراحی می شود. در صورتی که پرایمرها جهت پیشگیری از نتایج مثبت کاذب، با دقت کافی طراحی شوند هردوی این اهداف دست یافتنی می باشند. در زیر ملاحظاتی که هنگام طراحی پرایمر باید در ذهن داشته باشیم آورده شده است.
طول پرایمر در PCR :
طول یک پرایمر به طور مستقیم با ویژگی واکنش PCR متناسب است. همچنین طول پرایمر، دمایی را مشخص می کند که در آن پرایمر به DNA الگو متصل خواهد شد. معمولا پرایمرها در طولی بین 18 تا 24 باز طراحی می شوند اگر چه حداقل طول پرایمر به وسیله اندازه ژنوم تعیین می شود. یک
محتوای GC پرایمر در PCR :
محتوای GC مهم است زیرا مقدار Tm یک توالی را تعیین می کند. اولیگونوکلئوتیدی با طول 20 جفت بازی و حاوی 50% CG معمولا مقدار Tm بین 56 – 62 درجه سانتیگراد دارد. محتوای GC بسیار مطلوب باید بین 40 تا 60 درجه Tm سانتیگراد داشته باشد. از وجود بیش از سه نوکلئوتید C یا G در انتهای ‘ 3 پرایمر باید اجتناب شود زیرا ممکن است منجربه پرایمینگ غیر اختصاصی (اتصال غیراختصاصی پرایمر) شود.
دمای ذوب (Tm) پرایمرها :
ازآنجا که در یک واکنش PCR مجموعه ای از پرایمرها استفاده می شوند از این رو باید سعی شود تا جفت پرایمری هایی انتخاب شوند که Tm آن ها از همدیگر بیش از 5 درجه سانتیگراد اختلاف نداشته باشند، بنابراین محتوای GC و طول پرایمر باید بر این اساس انتخاب شوند. معمولا Tm در دامنه 62 – 70 درجه سانتیگراد قرار دارد.
برآورد دمای ذوب و دمای آنلینگ پرایمر:
برای پرایمرهای کمتر از 25 نوکلئوتید، تقریبا Tm با استفاده از فرمول زیرین محاسبه م ی شود: که در G، C، A، T
تعداد نوکلئوتیدهای مربوطه در پرایمر هست:
(Tm = 4(G+C) + 2(A+T
وارد کردن جایگاه محدود کننده در پرایمرها :
3-6 نوکلئوتید به انتهای ‘5 پرایمر اضافه می شود بنابراین به طور موفقیت آمیزی جایگاهی برای برش محدود کننده در توالی های تکثیر شده، فراهم می کند.
مکمل بودن پرایمر :
پرایمر نباید مکمل خود یا مکمل دیگر پرایمرهای موجود در مخلوط واکنش باشد، از این رو از وجود همولوژی داخل و بین پرایمرها باید پرهیز شود زیرا می تواند منجر به ایجاد دیمر پرایمر شود.
تکرار بازها :
از تکرار باز منفرد یا دو باز برای 4 مرتبه یا بیشتر باید پرهیز شود.
نوکلئوتید انتهایی در پرایمر PCR :
موقعیت انتهایی در پرایمر جهت حذف جفت شدن ناجور ضروری است. برای پرهیز از آن، از پرایمرهایی که در انتهاهای ‘ 3 خود مکمل
هستند، اجتناب شود زیرا این امر ممکن است سبب تشکیل غیرضروری دیمر پرایمر شود.
ساختارهای ثانویه :
از ایجاد ساختارهای ثانویه حتی المقدور باید پرهیز شود، ساختارهای ثانویه در نتیجه واکنش های بین مولکولی یا درون مولکولی به وجود می آیند. سنجاق سرها، دیمرهای خودی، دیمرهای متقابل، همه در نتیجه ساختارهای ثانویه حاصل می شوند.
dNTPs :
غلظت هر dNTP در مخلوط نهایی واکنش معمولا 200μM است و غلظت هر (dNTPs ,dATP, dCTP, dGTP, dTTP) باید یکسان باشد. غلظت نادرست حتی یک dNTP منفرد ممکن است سبب افزایش درج اشتباه نوکلئوتیدها در رشته جدید شود.
MgCl2 :
در طی همانند سازی یک جفت الکترون منفرد در ناحیه OH-‘3 زنجیر در حال تکثیر ظاهر می شود که برای تشکیل پیوند فسفودی استر توسط پلیمراز Taq استفاده می شود. این جفت الکترون منفرد جهت تبدیل dNTP به dNMP از طریق حمله نوکلئوفیلی بر روی اتم فسفات گروه α-فسفات استفاده شده و پیروفسفات (γ و β) آزاد می گردد؛ اما dNTP ورودی چهار بار منفی دارد و به علت وجود این بارهای منفی، از حمله نوکلئوفیلی جلوگیری به عمل می آید، بنابراین، +Mg2 با کلاته کردن بارهای منفی اضافی نوکلئوتید ورودی، حمله نوکلئوفیلی (هسته دوستی) و تشکیل پیوند و در نتیجه پلیمریزاسیون را تسهیل می کند.
همچنین همه آنزیم ها برای فعالیتشان نیاز به کوفاکتور دارند و یون فلزی +Mg2 به عنوان کوفاکتور ضروری برای DNA پلیمراز در PCR عمل می کند. یون +Mg2 جهت اتصال و ایجاد نیرو، وارد پروتئین شده و پلیمراز را قوی تر کرده تا بتواند به dNTP متصل شود اما به صورت اختصاصی این کار را انجام می دهد؛ بنابراین افزایش غلظت +Mg2 در PCR سبب پیوند قوی می شود اما احتمال تکثیر غیر اختصاصی نیز افزایش می یابد. بدین خاطر غلظت آن باید برای هر سیستم پرایمر الگو بهینه شود.
همچنین اجزای دیگر واکنش PCR شامل پرایمرهای، الگو، محصولات PCR و dNTPs به یون +Mg2 متصل می شوند. غیر از این ها dNTPs تمایل زیادی برای اتصال به یون +Mg2 دارند و به خاطر همین یون +Mg2 آزاد لازم است تا به عنوان کوفاکتور آنزیم در PCR عمل کند بنابراین غلظت تام یون +Mg2 باید بیشتر از غلظت تام dNTP باشد. دامنه غلظت توصیه شده برای MgCl2 در مخلوط استاندارد واکنش 1 تا 4mM است.
پیپت های خودکار، ظروف پلاستیکی و دستکش :
پیپت های خودکار (1 -10μl, 10-100μl & 100-1000μl)، لوله های میکروسانتریفویوژی ، سرسمپلرها، محل PCR و غیره در طول PCR و برای بارگذاری محصولات تکثیر یافته در ژل آگارز لازم هستند.
ترمال سایکلر (سایکلر حرارتی) :
ابزاری است که دما را در طول هر چرخه برای دناتوراسیون، آنلینگ، بسط و روند نگهداری بسیار سریع تغییر می دهد.
اصول، روش و آشکارسازی پس از تکثیر PCR
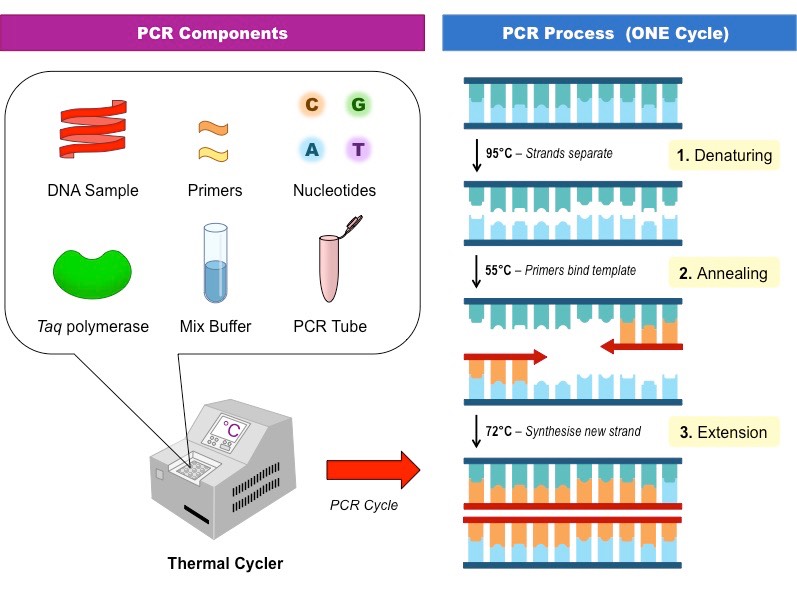
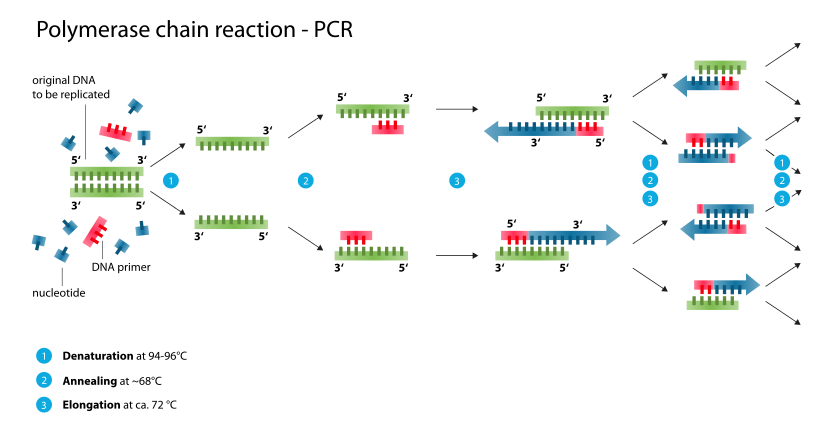
اصول PCR بر پایه این واقعیت استوار است که در دمای دناتوراسیون بالا نزدیک 95 درجه سانتیگراد، دو رشته مولکول DNA هدف به علت شکستن پیوندهای G-C و A-T از هم جدا می شوند. در دمای های آنلینگ در دامنه 50 تا 60 درجه سانتیگراد پرایمرهای مکمل جلو (Forward) و معکوس (Reverse) به انتهای ‘ 3 اتصال یافته و مولکول DNA هدف تک رشت های را از دو طرف محصور می کنند.
سپس پلیمراز Taq رشته جدید DNA را با اضافه کردن dNTP ها توسعه داده و مولکول دو رشته ای خودش را در دمای توسعه 72 درجه سانتیگراد بازسازی می کند. این روند چند بار تکرار شده و چندین نسخه از مولکول DNA هدف را به وجود می آورد (شکل زیر). برای نتایج بهتر، دستوالعمل های عملی شبکه کیفی ژنتیک مولکولی اورپا (EMQN) باید مورد مطالعه قرار گیرد.
روش انجام کار :
ابتدا دناتوراسیون در دمای 90 تا 95 درجه سانتیگراد به مدت DNA 3-5 دقیقه صورت می گیرد و طی آن دو رشته مولکول دو رشته ای هدف از هم جدا می شوند. دناتوراسیون اولیه توسط 30 تا 35 چرخه دناتوراسیون، آنلینگ و توسعه دنبال می شود. تعداد چرخه PCR بستگی به مقدار DNA الگو در مخلوط واکنش و بازده مورد انتظار محصول PCR دارد.
دناتوراسیون شامل حرارت دادن مولکول دو رشته ای DNA هدف در دمای 90 تا 95 درجه سانتیگراد به مدت 30 تا 35 ثانیه است. مرحله آنلینگ اجازه اتصال پرایمرهای مکمل Forward و Reverse به ناحیه طرفین DNA الگو را در دمای 50 تا 65 درجه سانتیگراد در مدت 30 تا 55 ثانیه می دهد.
مرحله بسط پرایمر در دمای 72 درجه سانتی گراد به مدت 30-55 ثانیه رخ می دهد و طی آن dNTP های مکمل به رشته های جدید اضافه می شوند. پس از چرخه نهایی، معمولا نمونه ها در دمای 72 درجه سانتیگراد به مدت 5 تا 15 دقیقه جهت پر کردن انتهاهای بیرون زده محصولات PCR جدیدا سنتز شده، انکوبه می شوند. ذخیره و نگهداری محصولات PCR در دمای 4 درجه سانتیگراد به مدت زمان نامحدود می تواند صورت بگیرد.
آشکارسازی پس از تکثیر
پس از الکتروفورز محصول PCR توسط ژل آگارز، ژل آگارز با محلول اتیدیوم بروماید (EtBr) رنگ آمیزی می شود و سپس در زیر تابش نور UV محصول PCR در ژل به صورت رنگ صورتی مشاهده می شود. اتیدیم بروماید سال های زیادی برای رویت اسیدهای نوکلئیک در ژل آگارز استفاده شده است. البته اتیدیم بروماید جهش زای بالقوه بوده و سبب جهش در سلولهای زنده می شود؛ بنابراین ژل باید در یک ظرف زباله اختصاصی گذاشته شود که با علامت خطر نشان دار شده و تاریخ گذاری شده و به بخش زیست محیطی و ایمنی تحویل داده شود.
فیلم آموزشی در مورد کلنی PCR
(Colony PCR) یک روش آسان برای تشخیص سریع عمل لیگاسیون می باشد که موجب صرفه جویی در وقت و هزینه می شود.





