تکنیک وسترن بلات
تکنیک بلاتینگ
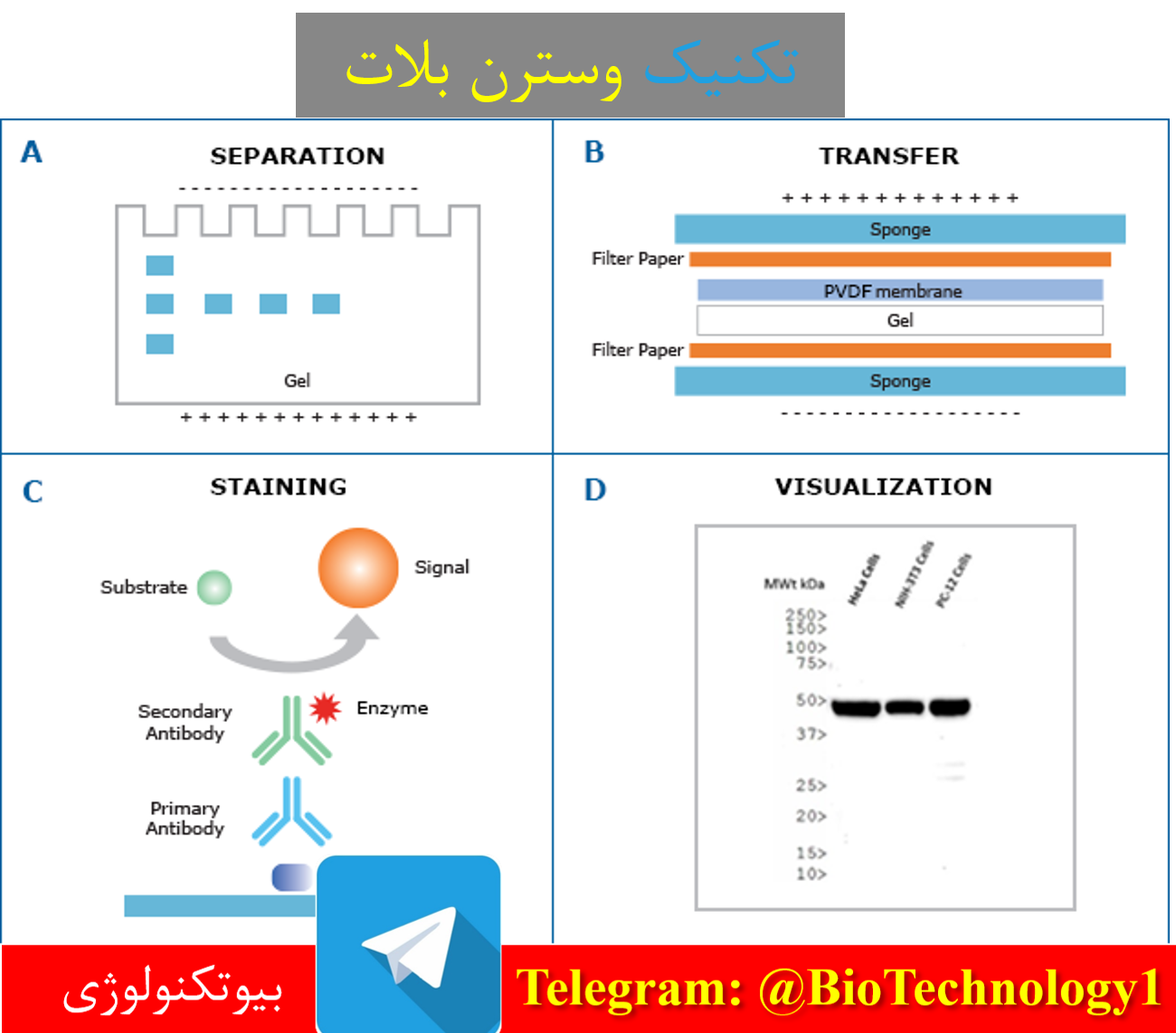
در این تکنیک باندهای پروتئینی از ژل به غشایی ماننده نیتروسلولز که قابلیت اتصال و تثبیت پروتئین ها را دارد، منتقل می شوند. در عمل بلاتینگ مولکول های پروتئین از زمینه ژل خارج می شوند و در سطح غشا در همان موقعیت قرار می گیرند. از این رو به سادگی و با مقدار کمتری از مواد می توان به مطالعه آنها پرداخت، یا آنها را جدا نمود و مورد استفاده قرار داد. به منظور تشخیص پروتئین ها یا آنزیم های منتقل شده به غشا می توان از لیگاندهای اختصاصی یا سوبستراهای مربوطه استفاده کرد. آنتی بادی ها از متداول ترین موادی هستند که برای تشخیص اختصاصی پروتئین ها در غشا بکار می روند. از همین رو
چنین روش هایی به ایمونوبلاتینگ معروفند.
شکل ۱) مراحل کامل شناسایی پروتئین با استفاده از تکنیک بلاتینگ
روش های انتقال پروتئین
در اغلب موارد انتقال پروتئین از غشا به ژل با کمک نیروی الکتریکی صورت می گیرد. این نوع انتقال به انتقال الکتروفورزی معروف است. انتقال الکتروفورزی به دو صورت انجام می شود: انتقال در تانک که به انتقال تر معروف است و انتقال به روش نیمه خشک.
البته می توان به طریق انتشار با خاصیت مویینگی یا پمپ خلا نیز پروتئین ها را انتقال داد.
غشاهای مورد استفاده در بلاتینگ
در عمل بلاتینگ معمولا از غشاهای نیتروسلولزی و یا پلی وینیلیدن دی فلورید (PVDF) استفاده می کنند. این دو غشا ظرفیت خوبی در اتصال به پروتئین ها دارند. نیتروسلولز ارزان تر است ولی ظرفیت مکانیکی کمی دارد و شکننده می باشد. اندازه منافذ نیتروسلولز بین 0.05 تا 0.45 میکرون متغیر می باشند. هرچه اندازه منافذ یک غشا کوچک تر باشد سطح مخصوص و ظرفیت اتصال آن بیشتر خواهد بود.
دی آزو بنزیل اکسی متیل (DBM)، دی آزو فنیل تیواتر (DPT) و نایلون از دیگر غشاهایی هستند که در موارد خاصی از عمل بلاتینگ بکار می روند. غشاهای نایلونی از ظرفیت و توان مکانیکی بالایی برخوردارند، اما بر خلاف سایر غشاها بار مثبت دارند. از این رو اغلب رنگ های آنیونی که برای پروتئین مورد استفاده قرار می گیرند، به آنها متصل میشوند. در مواردی که جداسازی پروتئین خاصی از غشا مورد نظر باشد، استفاده از غشاهای تعویض یون برای بلاتینگ مناسب می باشد. برای این کار قسمتی از غشا که حوای پروتئین مورد نظر است ، جدا می شود. سپس با قرار دادن قسمت جدا شده در بافر با PH یا قدرت یونی متفاوت ، پروتئین آزاد می شود.
روش انتقال در تانک
روش انتقال در تانک شکل پایه ای انتقال به کمک الکتروفورز می باشد. بدین لحاظ غالبا این روش را معادل الکتروبلاتینگ می دانند. تصویر کلی این روش در شکل زیر آمده است. معمولا انتقال در تانک در بافر تریس-گلیسین انجام می گیرد. این بافر برای جداسازی انواعی از پروتئین ها که به روش SDS-PAGE جداشده اند مناسب است. وجود متانول در این بافر برای جلوگیری از تورم ژل، جداسازی SDS از پروتئین ها و بالا بردن ظرفیت اتصال به غشا است. اما ، متانول بخصوص در غلظت های بالا از عوامل بازدارنده انتقال پروتئین ها محسوب می شود. در بعضی موراد به منظور افزایش حلالیت پروتئین ها مقداری دترجنت (به عنوان مثال SDS با غلظت 0.2 درصد) به این بافر می افزایند. به هر حال باید توجه داشت که دترجنت ها به خصوص در غلظت های بالا از اتصال پروتئین ها به غشا جلوگیری می نمایند.
مواد لازم جهت انجام تکنیک ایمونوبلات
غشای نیتروسلولز با اندازه منافذ 0.45 میکرومتر یا غشای ایموبیلون (PVDF)
بافر انتقال حاوی تریس ۲۵ میلی مولار، گلیسین ۱۹۲ میلی مولار و متانول ۱۵ درصد. برای تهیه آن ۶ گرم تریس باز و 8.28 گرم گلیسین را در حدود یک لیتر آب مقطر حل کنید. سپس ۲۰۰ میلی لیتر متانول اضافه کنید، حجم نهایی را با آب مقطر به ۲ لیتر برسانید (PH این محلول حدود 3.8 است و نیازی به تنظیم ندارد). بافر را در یخچال قرار دهید تا قبل از استفاده خنک گردد، چون حل شدن متانول در آب گرمازاست.
کاغذ واتمن یا کاغذ الکتروفورز
روش آزمایش
مقداری از بافر تانک را در یک ظرف پلاستیکی یا شیشه ای تمیز بریزید. ژل را پس از بریدن بخش متراکم کننده آن حداقل ۱۰ دقیقه در بافر قرار دهید. با کمک پنس و قیچی تمیز، یک ورقه از غشا به اندازه ژل ببرید. از تماس دست بدون دستکش با
غشا خودداری کنید. غشا را با آب مقطر (برای غشای نیتروسلولز) یا متانول (برای غشای PVDF ) خیس کنید و در ظرف حاوی بافر انتقال دهید. چندین لایه کاغذ صافی متناسب با ابعاد ژل تهیه و همراه اسفنج ها در بافر خیس کنید و در بافر خیس کنید. سپس مطابق شکل زیر اجزای گفته شده را روی هم قرار دهید. این مجموعه از پایین به بالا شامل اسفنج، چند لایه کاغذ صافی، ژل، غشا، چند لایه کاغذ صافی و لایه اسفنج می باشد. بعد از گذاشتن هر لایه، حباب های هوای احتمالی را با یک میله شیشه ای یا لوله آزمایش از حد فاصل لایه ها خارج کنید.
شکل ۳) انتقال به روش تر
مجموعه بلات را در قاب پلاستیکی مربوطه محکم کنید و در تانک بلات که تا ارتفاع مناسب با بافر پر شده است، قرار دهید. سپس به مدت ۱- ۴ ساعت در شدت جریان ۲۰۰ – ۴۰۰ میلی آمپر الکتروفورز نمایید.
انتخاب بافر در الکتروبلات
انتخاب بافر و استفاده از متانول در بافر بستگی به نوع پروتئین های مورد مطالعه ، شرایط ژل ، نوع الکتروفورز و نوع غشا دارد. همانگونه که قبلا نیز ذکر شد، بافر تریس-گلیسین- برای انتقال اغلب پروتئین ها مناسب می باشد. پروتئین ها در این بافر معمولا بار منفی دارند و به طرف آند حرکت می کنند.
اتصال SDS به پروتئین ها (برای مثال در SDS-PAGE ) نیز به تشدید بار منفی و حرکت آنها کمک می کند. با این حال در بعضی موارد تغییر شرایط بافر تریس-گلیسین یا انتخاب بافر دیگر می تواند انتقال را تسهیل نماید. به عنوان مثال، تجربه نشان میدهد که با حذف متانول در بافر تریس-گلیسین انتقال گلیکوپروتئین های بزرگ به راحتی صورت می گیرد. متانول با زدودن SDS از پروتئین ها و جمع کردن ژل باعث کاهش انتقال این مولکول ها می شود. SDS یک دترجنت آنیونی است و در انتقال پروتئین ها (خصوصا پروتئین های با بار خالص مثبت) تاثیر گذار می باشد. بنا بر این در صورت نیاز، علاوه بر حذف متانول، می توان درصد بسیار کمی از آن را وارد بافر کرد. انتقال در بافر CAPS پنجاه میلی مولار سریعتر صورت می گیرد و با تولید گرمای کمتری همراه است. بدین لحاظ در صورت لزوم می توان از این بافر به جای تریس-گلیسین استفاده کرد. در حالاتی که بلاتینگ به هدف تعیین توالی اسیدهای آمینه در پروتئین ها صورت می گیرد، بافر CAPS مناسب تر است. زیرا حضور گلیسین در بافر موجب اختلال در تعیین توالی پروتئین ها می شود.
بافر بورات سدیم ۱۰ میلی مولار با 9.2 = PH را برای انتقال گلیکوپروتئین ها، پلی ساکاریدها و لیپوپلی ساکاریدها توصیه می کنند. در این بافر ، بورات به واحدهای قندی مواد فوق متصل می شود و به آنها بار منفی می دهد. پروتئین های بازی که در شرایط اسیدی الکتروفورز میشوند، یا پروتئین هایی که با تکنیک ایزوالکتروفوکوسینگ جدا می شوند، را می توان در محلول اسید استیک 0.7 درصد به غشا انتقال داد. در این شرایط پروتئین ها بار مثبت دارند و به طرف قطب منفی حرکت می کنند.
رنگ آمیزی عمومی پروتئین ها در غشا
بعد از بلاتینگ پروتئین ها لازم است اطلاعاتی در مورد کیفیت و کمیت باندهای انتقال یافته بدست آید، یا پروتئین خاصی به هدف مطالعات بعدی (مثلا تعیین توالی) مشخص گردد. برای این کار می توان غشای نیتروسلولز یا PVDF را با مواد مختلف رنگ امیزی نمود . رنگ آمیزی پروتئین ها بسته به هدف آزمایش ممکن است به صورت قابل برگشت و یا غیر قابل بزگشت باشد. پانسو-اس، جوهر هندی، آمیدوبلک و کوماسی آبی از مواد متداول برای رنگ آمیزی عمومی پروتئین ها در غشا هستند. رنگ آمیزی ژل نیز کامل یا ناقص بودن انتقال پروتئین ها را نشان می دهد. باندهای پروتئین در ژل و غشا دقیقا هم موقعیت نمی باشند، زیرا ژل در طی متعادل سازی در محلول انتقال به دلیل وجود متانول ، مقداری کوچک می شود.
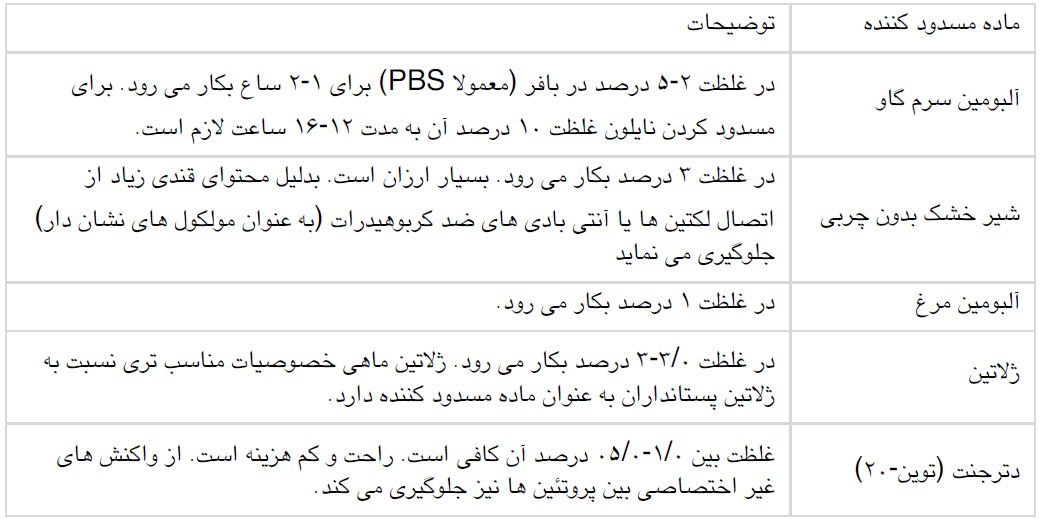
جدول ۱) موادی که برای رنگ آمیزی عمومی پروتئین ها در غشا بکار می روند.
رنگ آمیزی قابل برگشت با پانسو- اس
محلول رنگ آمیزی شامل پانسو-اس 0.1 درصد وزنی-حجمی در اسید استیک ۵ درصد حجمی -حجمی است. محلول آماده آن نیز توسط شرکت های مختلفی عرضه می شود. برای رنگ امیزی غشا را به مدت 5 تا 10 دقیقه در مقدار کافی محلول رنگ قرار دهید. سپس با آب مقطر بشویید تا زمینه غشا بی رنگ گردد. باندهای پروتئینی بعد از رنگ امیزی به رنگ قرمز در می آیند. اگر شستشو با آب ادامه یابد، باندها نیز بی رنگ می گردند. رنگ امیزی با پانسو-اس دخالتی در تشخیص باندها به روش اختصاصی (مثلا ایمونوبلاتینگ) یا در تعیین توالی اسیدآمینه ها ندارد. حساسیت این روش نشبتا پایین می باشد.
رنگ آمیزی قابل برگشت با آمیدوبلک
محلول رنگ امیزی شامل آمیدوبلک با غلظت 0.1 درصد وزنی –حجمی در آب مقطر می باشد. برای رنگ آمیزی، غشا را ۲۰ تا ۳۰ دقیقه در مقدار کافی محلول رنگ قرار دهید. سپس با آب بشویید تا زمینه غشا بیرنگ گردد. رنگ باندهای پروتئینی به تدریج ضعیف و بالاخره ناپدید می شود.
رنگ آمیزی غیر قابل بازگشت با کوماسی بلو
محلول رنگ امیزی شامل کوماسی بلو R-250 با غلظت 0.1 درصد وزنی حجمی در محلول اسید استیک ۷ درصد حجمی-حجمی و متانول ۵۰ درصد حجمی-حجمی در آب مقطر است. محلول رنگ بر شامل اسید استیک ۷ درصد و متانول ۵۰ درصد در آب مقطر است. رنگ امیزی ژل با کوماسی بلو نیز با همین محلول ها صورت می گیرد. غشا را ۱۵ دقیقه در مقدار کافی محلول رنگ قرار دهید. محلول رنگ را تخلیه کرده، غشا را در محلول رنگ بر بشویید تا زمینه آبی آن بی رنگ گردد. سپس غشا را در آب مقطر بشویید.
کوماسی بلو برای رنگ آمیزی پروتئین ها در PVDF مناسب است. این نوع رنگ را برای رنگ آمیزی نیتروسلولز بکار نبرید. زیرا زمینه آن شدیدا رنگی می شود.
رنگ آمیزی غیر قابل برگشت با آمیدوبلک
محلول رنگ آمیزی شامل آمیدوبلک آمیدوبلک 0.5 درصد وزنی حجمی، اسید استیک ۵ درصد حجمی حجمی و متانول ۵۰ درصد حجمی-حجمی در آب مقطر است.
محلول رنگ بر شامل اسید استیک ۵ درصد و متانول ۵۰ درصد در آب مقطر است.
غشا را ۵ دقیقه در محلول رنگ بر قرار دهید. محلول رنگ آمیزی را تخلیه کنید و غشا را با محلول رنگ بر بشویید تا زمینه آبی رنگ شود.
رنگ آمیزی مارکرهای پروتئینی
تعیین برخی از خصوصیات پروتئین ها همچون اندازه یا نقطه ایزوالکتریک (PI) با استفاده از مارکر های پروتئینی صورت میگیرد. برای تشخیص مارکرها در غشا می توان از روش های زیر کمک بگیرید.
قسمت مربوط به مارکرها را از بقیه غشا جدا نمایید و با یکی از روش های غیر قابل برگشت که در صفحات قبل به آنها اشاره شد، رنگ آمیزی نمایید (PVDF را با کوماسی و نیتروسلولز را با آمیدوبلک رنگ کنید.) سپس این بخش از غشا را خشک نمایید و در کنار بقیه نتایج قرار دهید. بسته به نوع برند موقعیت مارکرها و تعداد باندشان متفاوت است. می توان شکل بیوتینه شده مارکرها را تهیه کرد و یا مارکرها را در آزمایشگاه به بیوتین متصل نمود. تحت چنین شرایطی با در اختیار داشتن کونژوگه آویدین-پراکسیداز یا آویدین و کونژوگه آنتی آویدین-پراکسیداز می توان موقعیت مارکرها را مشخص نمود.
آلبومین مرغی و آلبومین گاوی از پروتئین هایی هستند که در بسیاری از انواع مارکرها وجود دارند. با در اختیار داشتن آنتی بادی ضد این دو پروتئین به صورت کانژوگه با آنزیم (یا آنتی بادی ضد آنها و آنتی بادی ثانویه کانژوگه) می توان موقعیت آنها را در غشا تعیین ساخت. این روش زمانی در غشا استفاده (inhibitor) قابل اجرا است که از این پروتئین ها به عنوان ماده مسدود کننده نشود.
تشخیص اختصاصی پروتئین ها در غشا
تشخیص یا رنگ آمیزی اختصاصی باندهای پروتئینی در غشا، بر پایه واکنش آنها با لیگاندهای اختصاصی صورت می گیرد. برای انجام این کار مولکول های لیگاند را به طور مستقیم (اولیه) و یا غیر مستقیم (ثانویه) با مواد رادیواکتیو، فلورسانس، مواد رنگی یا آنزیم ها نشان دار می کنند و با کمک آنها به تشخیص اختصاصی پروتئین ها می پردازند. آنتی بادی ها از پر استفاده ترین لیگاندهای اختصاصی هستند که به اهداف مختلف تشخیص اختصاصی پروتئین ها می پردازند. آنتی بادی ها از پر استفاده ترین
لیگاندهای اختصاصی هستند که به اهداف مختلف تشخیصی یا پژوهشی به کار می روند. اساس روش ایمونوبلاتینگ که اهمیت آن بر محققین علوم زیستی آشکار است، موید چنین ادعایی است.
تکنیک وسترن بلاتینگ
این روش که به ایمونوبلات نیز معروف است بر پایه واکنش اولیه آنتی بادی-آنتی ژن می باشد. در این روش پس از بلاتینگ پروتئین ها، ابتدا مناقط آزاد غشا مسدود می شود (مرحله بلوکه کردن). سپس شرایط واکنش آنتی بادی (برای مثال سرم بیمار) با باندهای پروتئینی فراهم می گردد و به دنبال آن ، با استفاده از ماکرومولکول های نشان دار (برای مثال آنتی بادی ضد ایمونوگلوبولین انسان که به آنزیم متصل است) نتیجه واکنش اولیه معلوم می گردد. امروزه وسترن بلاتینگ را به طور گشترده در تشخیص طبی و تحقیقات بکار می برند. اگرچه انجام این روش تابع یک سری اصول کلی است، با این حال شرایط و جزئیات آن
وابسته به هدف آزمایش است.
مرحله مسدود سازی
غشاهای مورد استفاده در بلاتینگ ظرفیت زیادی برای گرفتن پروتئین ها دارند (برای مثال ۱۰۰ میکروگرم در هر سانتیمتر مربع از غشای نیتروسلولز) دارند. این خصوصیت اگرچه در جای خود بسیار مطلوب است ولی با اتصال غیر اختصاصی پروتئین های نشان دار در مراحل بعدی آزمایش به بروز اختلال در تشخیص منجر می شود. از این رو باید مناطق آزاد غشا قبل از مراحل تشخیص مسدود گردد. بهترین راه مسدود کردن این مناطق آزاد استفاده از پروتئین هایی است که خود با مواد نشان دار (مثل آنتی بادی) واکنش نمی دهد. کم هزینه بودن و سهولت تهیه از معیارهای اصلی انتخاب پروتئین مسدود کننده است. در
جدول زیر نام و غلظت کاری تعدادی از پروتئین های مسدود کننده آمده است. دترجنت ها نیز می توانند از اتصال پروتئین ها به غشا جلوگیری کنند.تویین20 معمولترین دترجنت مورد استفاده در این کار است. باید این نکته را توجه کرد که تویین ۲۰ در غلظت های بالا (بیش از نیم درصد) در پاره ای موارد از اتصال لیگاند به پروتئین نیز جلوگیری میکند.
تشخیص با آنتی بادی
پس از بلاتینگ پروتئین ها و بلوکه کردن غشا، مرحله تشخیص اختصاصی را می توان انجام داد. همانگونه که قبلا نیز گفته شد ایمونوبلاتینگ در بسیاری از موارد به هدف تشخیص طبی است. در این موارد باندهای انتقال یافته شامل همه یا بخشی از پروتئین های پیکره میکروب (باکتری، ویروس یا قارچ) است که وجود یا عدم وجود آنتی بادی ضد سرم آنها در سرم انسان یا حیوان بررسی می گردد. شکل زیر نمونه ای از این نوع ایمونوبلاتینگ را نشان می دهد.
مواد
- بافر تریس نمکی با PH 7.5 (TBS). این بافر شامل تریس 20 میلی مولار و کلرید سدیم 15/0 مولار است.
- بافر تریس نمکی حاوری توین 05/0 درصد (TBS-T). به هر لیتر از بافر تریس نمکی 5/0 میلی لیتر توین- 20 اضافه شود.
- آنتی بادی اولیه (سرم بیمار یا حیوان ایمن شده). در صورت لزوم با TBS-T رقیق می گردد.
- آنتی بادی ثانویه . این آنتی بادی ضد بخش ثابت آنتی بادی اول است و با آنزیم (پراکسیداز) کونژوگه شده است. رقت مورد نیاز از این آنتی بادی در TBS-T تهیه می شود.
- محلول سوبسترای آنزیم پراکسیداز شامل دی آمینو بنزیدین 5/0 میلی گرم در میلی لیتر و پراکسید هیدروژن 1/0 درصد در TBS است.
روش آزمایش
- پس از مرحله مسدودسازی، غشا را 3 بار، هربار 5 دقیقه در TBS-T بشویید. سپس 1-2 ساعت در آنتی بادی اول قرار دهید.
- غشا را 4 بار هر بار 5 دقیقه در TBS-T بشویید. سپس 1-2 ساعت در آنتی بادی ثانویه (آنتی بادی کانژوگه با پراکسیداز) قرار دهید.
- غشا را 4 بار هر بار 5 دقیقه در TBS-T بشویید. سپس آن را در معرض مقدار کافی از محلول سوبسترا قرار دهید. ظهور باندها معمولا 5-15 دقیقه طول می کشد. پس از ظهور باندها غشا را در آب مقطر زیاد بشویید. غشا را خشک کرده، در محل تاریک قرار دهید.
توجه شود که دی آمینوبنزیدین یک ماده بسیار سمی است. از تماس با آن خودداری کنید و در استفاده از آن دقت نمایید.