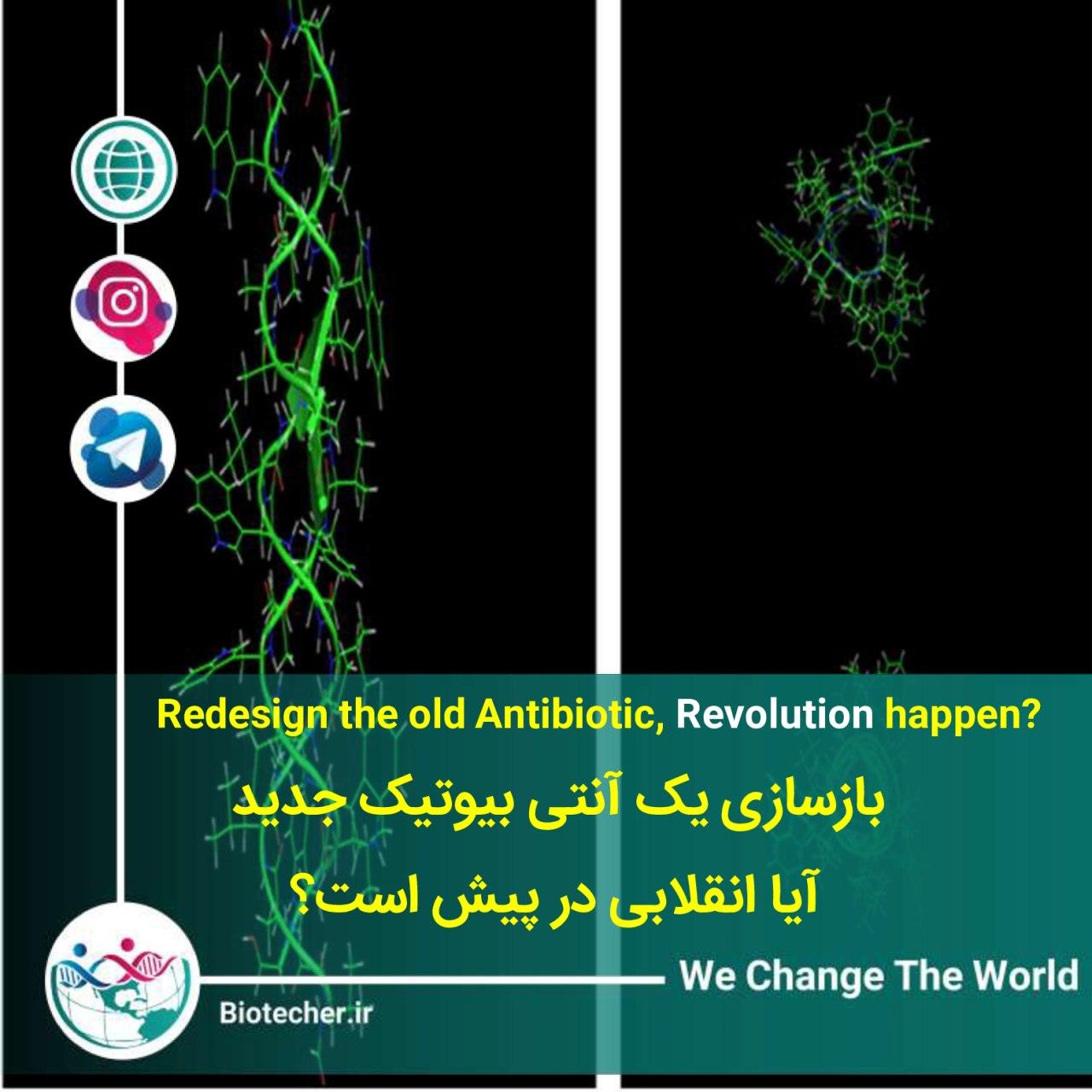
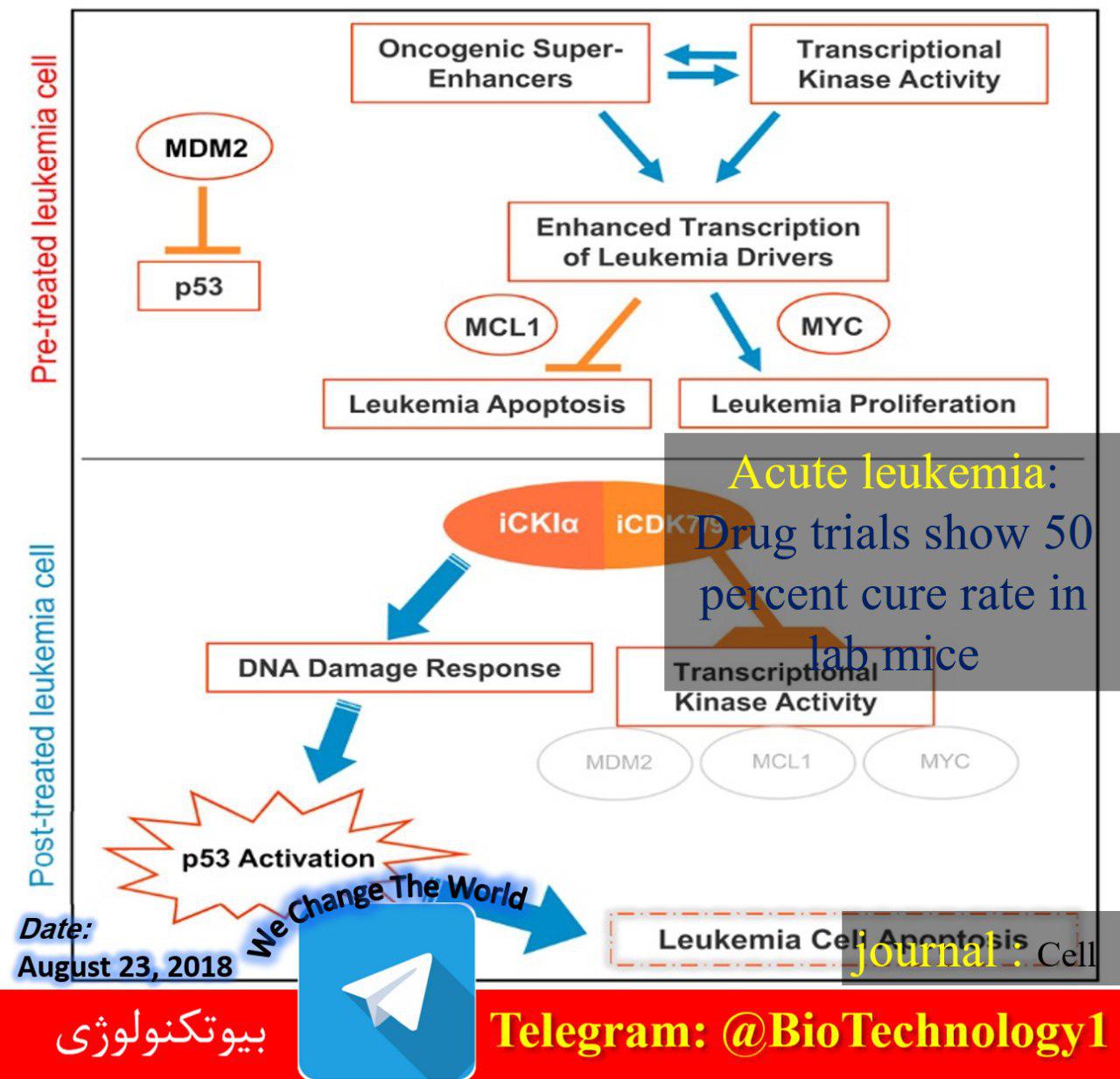
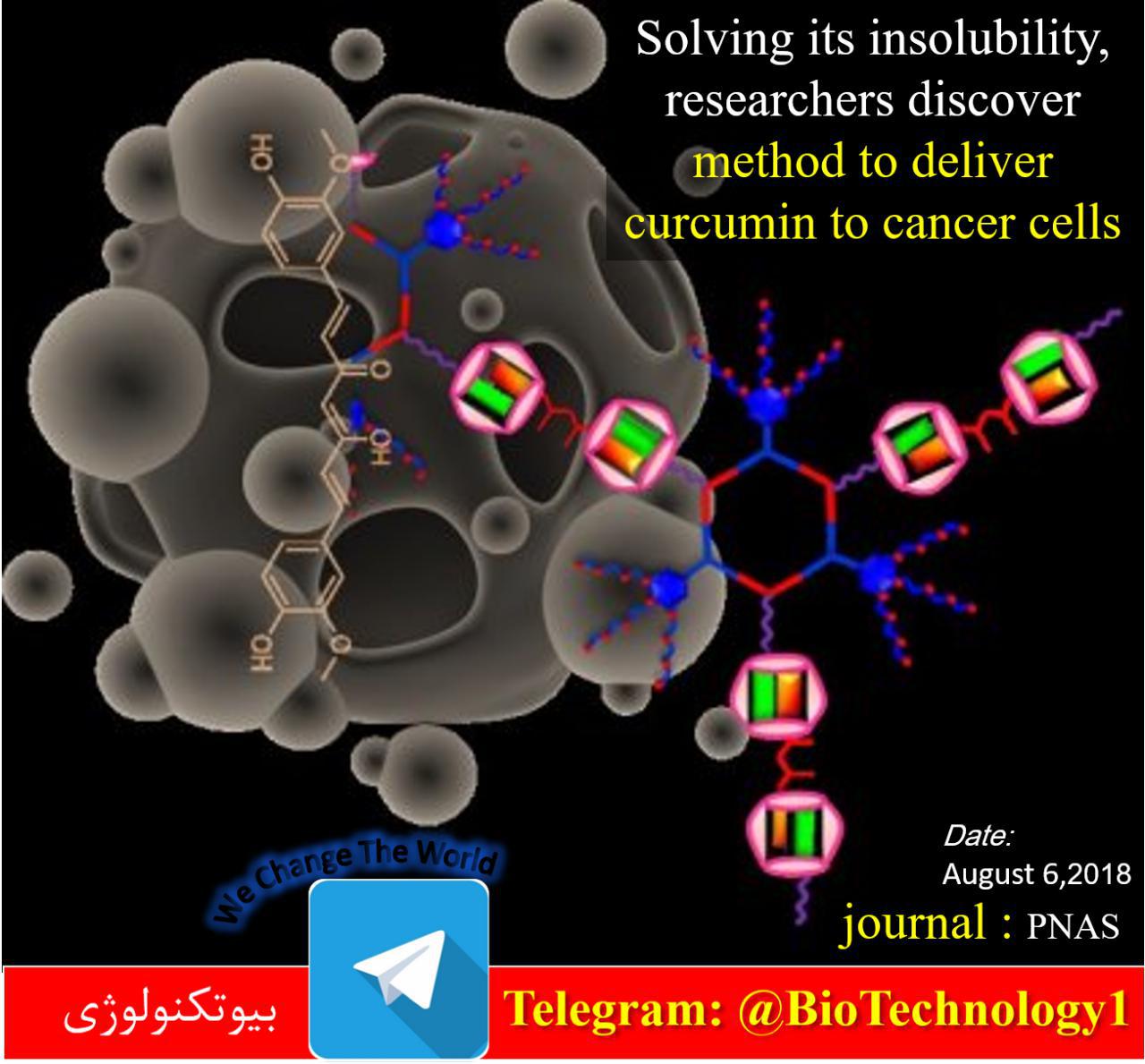
لیست انواع قرص رفع خماری الکل: 1. قرص آنتابوس 2. قرص دیسولفیرام 3. قرص نالترکسون 4. قرص آکامپروزات 5. قرص تتراهیدروکانابینول (THC) 6. قرص گاباپنتین 7. قرص بنزودیازپین ها (مثل دیازپام و لورازپام) 8. قرص آنتیدپرسان (مثل فلوکستامین و سرترالین)…
Edit Content
درباره ما
بیوتکر سفیر ترویج زیست فناوری و مرجع دانستی های بیوتکنولوژی. اینجا با هم کلی کتاب و مقاله علمی با موضوعات جذاب می خونیم
با ما تماس بگیرید
- تهران، میدان انقلاب، خیابان کارگر شمالی
- 09367305950
- saeedkargar@gmail.com
- ساعات کاری : شنبه تا جمعه (8 صبح تا 10 شب)