در دنیایی که هر روز شاهد پیشرفتهای چشمگیر علمی هستیم، دانشمندان با استفاده از ابزار اصلاح ژنی CRISPR گامی بزرگ برداشتهاند: خلق خوکهایی که در برابر ویروس مرگبار PRRS مقاوم هستند. این اکتشاف نه تنها میتواند جان میلیونها خوک را…
روش دیگر برای بررسی فیزیولوژی انسان، مطالعه سلولهای پستانداران است که در شرایط آزمایشگاهی کشت میشوند. بسیاری از رده های سلولی مختلف از انسان و میمون تولید شده است و میتوان آنها را در ظروف پلاستیکی یا فلاسک با استفاده…
زِبرافیش (گورخرماهی) کوچک با نام علمی Danio rerio یک مهره دار ساده است که در تحقیقات زیست شناسی مولکولی استفاده میشود. این ماهی به طور معمول برای نگهداری در آکواریومهای آب شیرین در فروشگاه های حیوانات خانگی یافت میشود. خصوصیاتی…
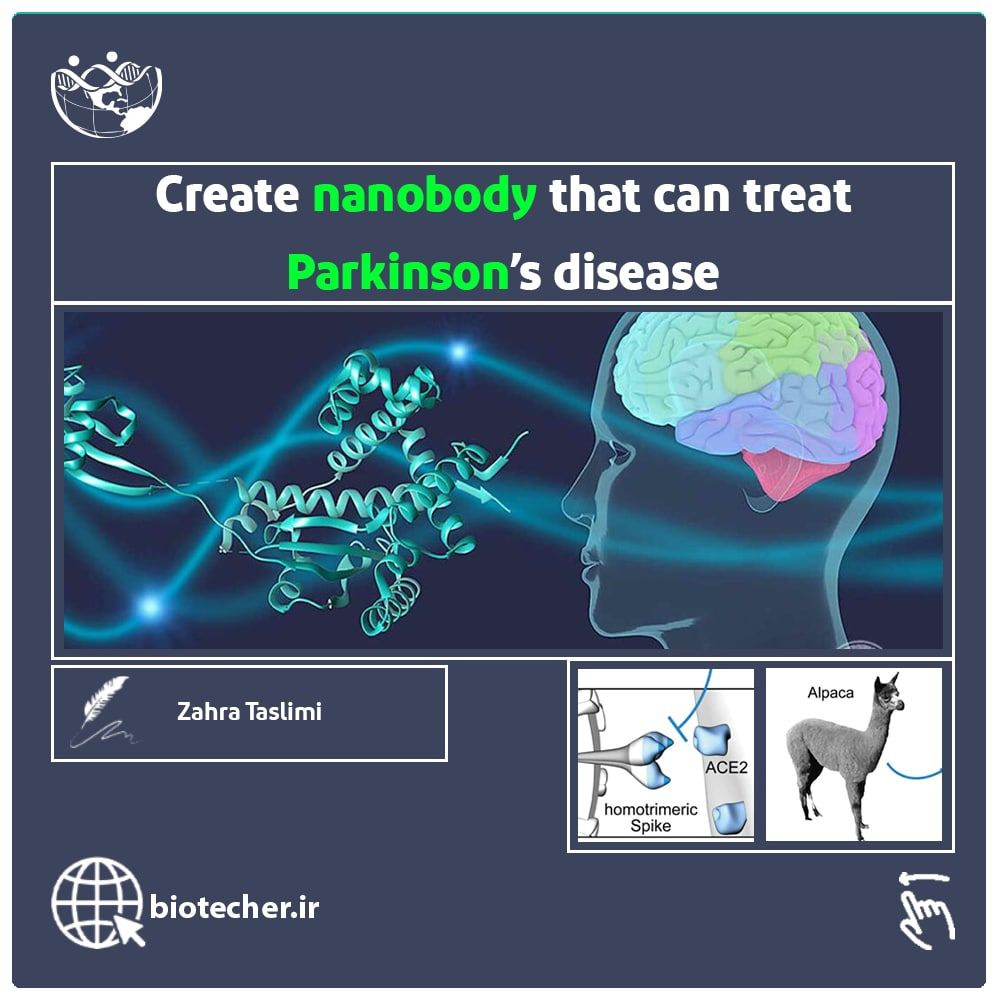
ساخت نانوبادی با پتانسیل درمان بیماری پارکینسون
شگفتی دیگر در علم / زنده کردن اندام های حیاتی خوک بعد از مرگ آن چند دقیقه بعداز آخرین ضربان های قلب، دسته ای از واکنش های بیوشیمیایی با کمبود جریان خون، اکسیژن و مواد غذایی آغاز می شود و…
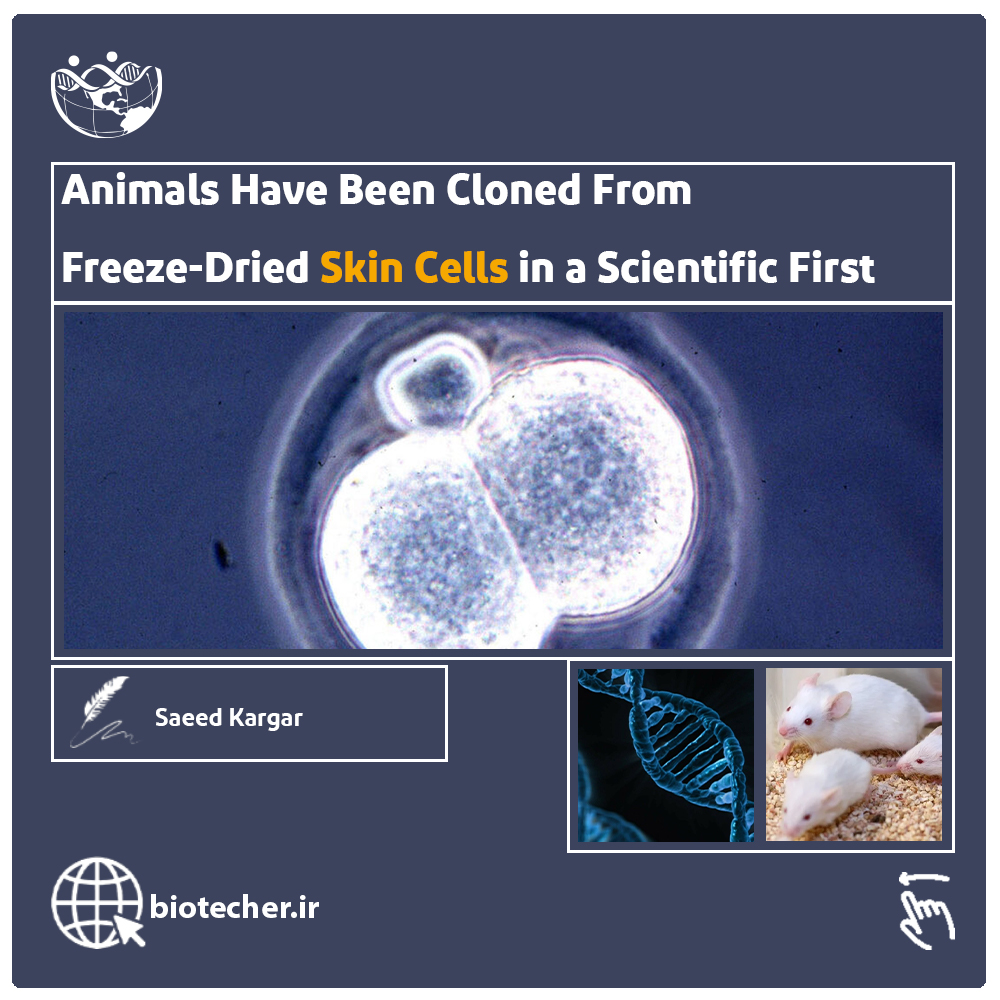
برای اولین بار یک حیوان از سلول های پوستی کلون شد کلون کردن سلول ها با استفاده از فریز و دراینگ با نرخ موفقیت پایین 0.2 درصد هنوز مسیر زیادی دارد تا به عنوان یک روش استاندارد کلونینگ و استراتژی…
محققان انستیتو پاستور فرانسه قدمی مهم برای یافتن درمان کرونا برداشتند. اطلاعات بیشتر در وب سایت بیوتکر
یک ژن انسانی خاص موجب بزرگ شدن ناحیه کورتکس در مارموست که یک پریمات هست می شود. بزرگ شدن مغز انسان بخصوص ناحیه کورتکس در طی تکامل، رابطه مستقیم با توانایی های انسان مانند زبان و استدلال دارد. یک ژن…
تاریخچه انسولین ۱۶ مه ۱۹۲۱، مرد قویهیکلی که بیشتر به دهقانها شباهت داشت وارد یکی از آزمایشگاههای دانشگاه تورنتو گردید. این مرد جوان ۲۹ساله موسوم به دکتر فردریک بانتینگ (F.Banting) بود که بعدها به عنوان یکی از بزرگترین کاشفان جهان پزشکی شناخته شد.…
اتوفاژی که حذف سلول های آسیب دیده و ساخت سلول های جدید و سالم است، کلیدی برای افزایش عمر می باشد. محققان با دستکاری ژنوم C. elegans و افزایش تولید p62 که پروتئینی مربوط به تخریب مواد زاید و اتوفاژی…
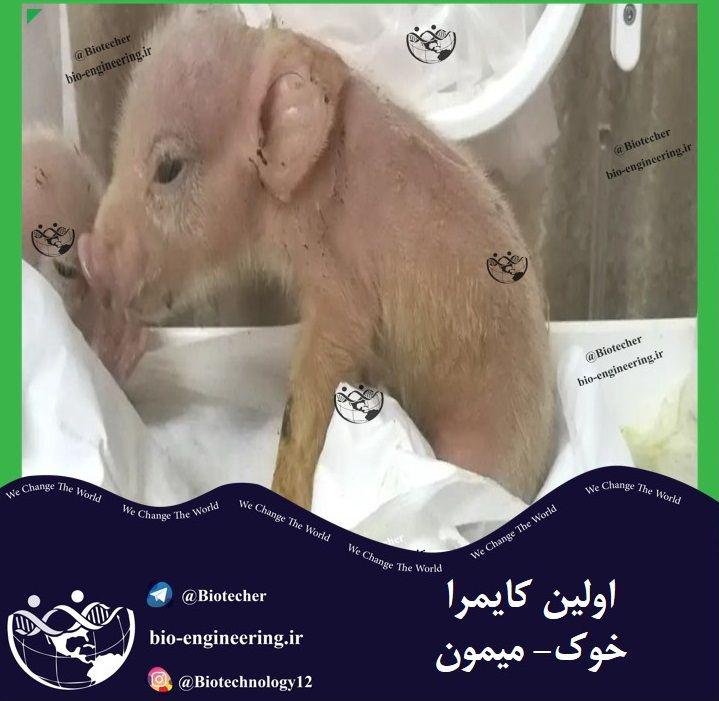
تولید خوکهای مهندسی شده که دارای سلول های میمون بودند، به مراحل پایانی رسیده و حتی زنده متولد شدند اما تنها برای چند روز زنده ماندند. اگرچه این کایمرا مردند اما این آزمایشات انجام شده در چین دستاورد مهمی برای…
سگ ها می توانند سرطان را تشخیص دهند !!! سگ ها دارای حس بویایی بسیار قویی بوده و می توانند به واسطه آن سرطان های مختلفی را تشخیص دهند. از جمله آن ها می توان به سرطان کلون، پروستات، سینه…
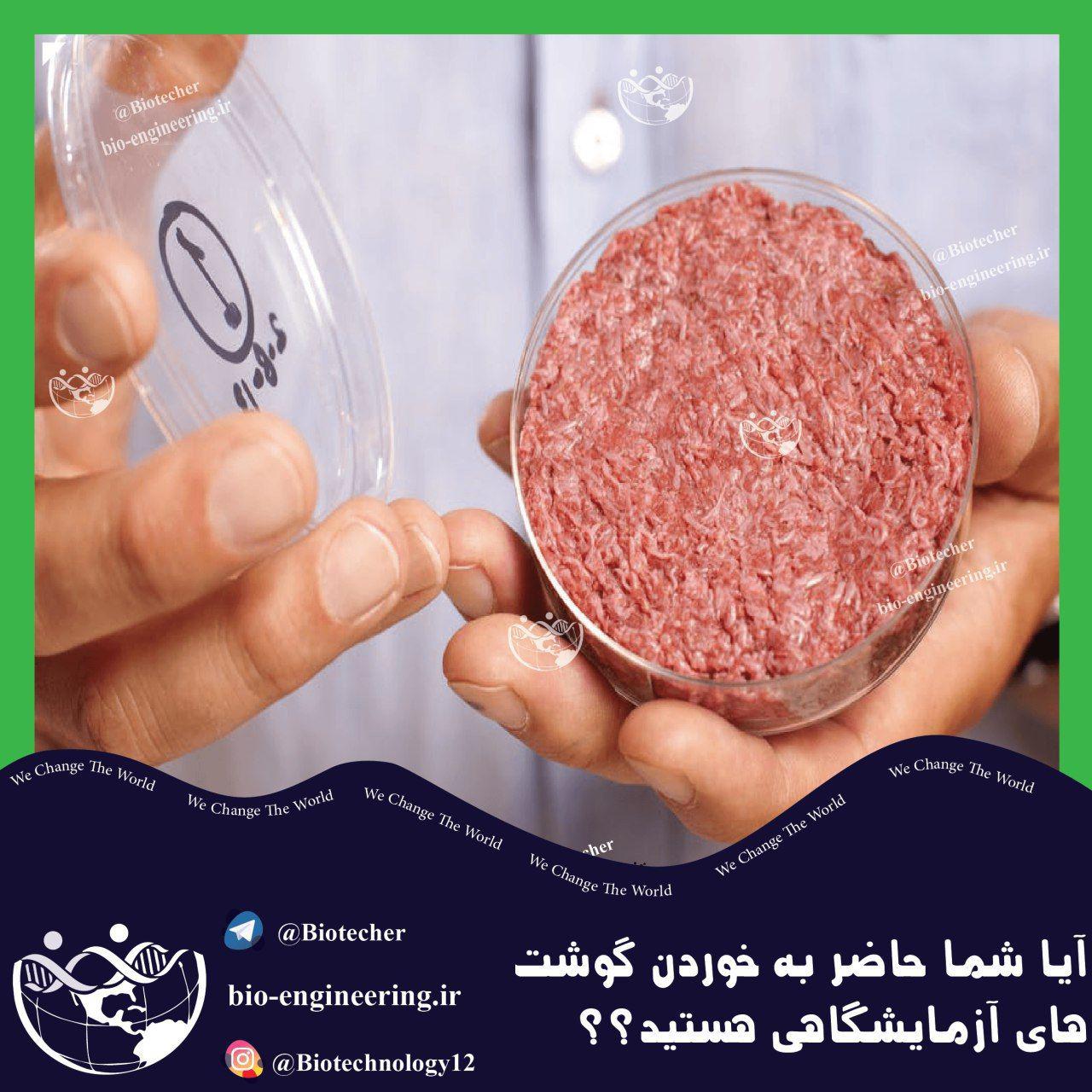
تولید گوشت در آزمایشگاه بدون حضور حیوانات استارت آپ گوشت تمیز Memphis Meats موج جدیدی از گوشت گاو و مرغی که در آزمایشگاه تولید می شود را راه انداخته است. این شرکت 17 میلیون دلار از سرمایه گذارانی از جمله…
ترمیم مو | کاشت مو تیمی از دانشمندان به سرپرستی دکتر تاتسوتو کاژیماما و پروفسور جونجی فوکودا، یک روش جدید برای ترمیم مو با استفاده از سلولهای بنیادی فولیکول مو موش ارائه دادند. این تیم، تارهای مو را در یک…